
عنوان التجربة
تحليل خليط من أيونات الحديد الثنائي (Fe+2) والحديد الثلاثي (Fe+3) باستخدام محلول قياسي من ثاني كرومات البوتاسيوم K2Cr2O7 تركيزه 0.05 مول/لتر
فكرة التجربة
تعتمد فكرة هذه التجربة على تقدیر آیون الحدیدوز بمعایرة مباشرة باستخدام محلول ثاني كرومات البوتاسیوم في وجود حمض الهیدروكلوریك المخفف + 1 مل من حمض الفوسفوریك المركز في وجود ثنائي فینیل أمین ، ثم یختزل ایون الحدیدیك بواسطة الهیدروجین النشیط الناتج من ذوبان قطع الزنك في حمض الهیدروكلوریك ویتم بذلك تقدیر الحدید الكلي (الحدیدوز الموجود أصلا في العینة + الحدیدوز الناتج من عملیة اختزال الحدیدیك)
الهدف من التجربة
تقدیر مولاریة وتركیز ایونات الحدید الثنائي والثلاثي في عینة ما عن طریق المعایرة باستخدام محلول قیاسي من ثاني كرومات البوتاسیوم 0.05 مول/لتر
معادلات التفاعل:
Fe+2 → Fe+3 + e–
Fe+3 + e– → Fe+2
Cr2O7-2 + 14H+ + 6e– → 2Cr+3 + 7H2O
المواد الكيميائية المستخدمة في تجربة تقدير تركيز أيونات الحديد الثنائي والحديد الثلاثي
(1) محلول عينة يحتوي على الحديد الثنائي (II) والحديد الثلاثي (III)
(2) محلول قياسي من ثنائي كرومات البوتاسيوم 0.05 مول/لتر.
(3) محلول حمض الهيدروكلوريك المخفف (HCl)
(4) محلول حمض الفسفوريك المركز (H3PO4)
(5) دلیل ثنائي فینیل امین
الأدوات المستخدمة
الأدوات المستخدمة فى التجربة هي أدوات معمل الكيمياء العادية مثل:
(1) قطارة
(2) سحاحة وحامل السحاحة
(3) ماصة قیاسیة
(4) دورق مخروطي400 مل
(5) كأس زجاجية سعة 400مل
(6) ساق زجاجیة
خطوات تجربة تقدير تركيز أيونات الحديد الثنائي والحديد الثلاثي
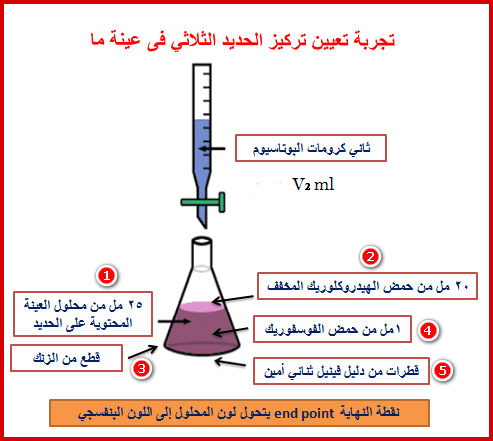
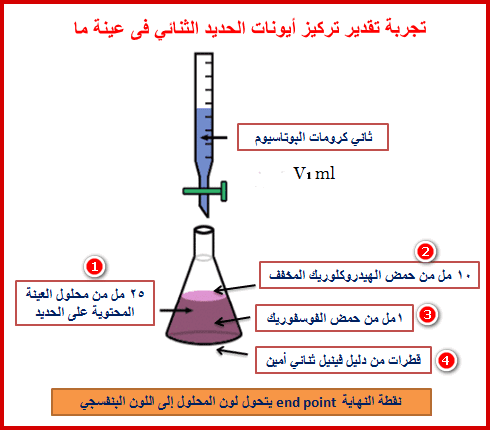
(1) خذ 25 مل بالماصة من محلول عينة الحديد المجهولة في دورق المعايرة ثم أضف 10 مل من محلول حمض الهيدروكلوريك المخفف (HCl)+ 1 مل محلول حمض الفسفوريك المركز (H3PO4)
(2) أضف قطرات من دلیل ثنائي فینیل أمین.
(3) ابدأ عملیة المعایرة بتنقیط محلول ثنائي كرومات البوتاسیوم القیاسي K2Cr2O7 قطرة قطرة مع الرج على محلول العينة.
(4) استمر في عملیة التنقیط حتى يتغیر لون المحلول إلي اللون البنفسجي.
(5) كرر هذه الخطوة ثلاثة مرات ثم خد متوسط الحجوم من ثاني كرومات البوتاسیوم القیاسي ولیكن (V1)
(6) خذ 25 مل بالماصة من محلول عينة الحديد المجهولة في دورق المعايرة ثم أضف 20 مل من محلول حمض الهيدروكلوريك المخفف (HCl)+ قطع من الزنك (يتم إذابة قطع الزنك) + 1 مل محلول حمض الفسفوريك المركز(H3PO4)
(7) أضف قطرات من دلیل ثنائي فینیل أمین.
(8) ابدأ عملیة المعایرة بتنقیط محلول ثنائي كرومات البوتاسیوم القیاسي K2Cr2O7 قطرة قطرة مع الرج على محلول العينة.
(9) استمر في عملیة التنقیط حتى يتغیر لون المحلول إلي اللون البنفسجي.
(10) كرر هذه الخطوة ثلاثة مرات ثم خد متوسط الحجوم من ثاني كرومات البوتاسیوم القیاسي ولیكن (V2)

الحسابات
V1 يمثل حجم K2Cr2O7 الذي یكافئ الحدید الثنائي (الحدیدوز) (Fe+2)
V1 = Fe+2
V2 يمثل حجم K2Cr2O7 الذي یكافئ الحدید الثنائي (الحدیدوز) (Fe+2) والحديد الثلاثي (الحديديك) معاً (Fe+3)
V2 = Fe+2 + Fe+3
ومن المعادلتين نجد أن:
V2 = V1+ Fe+3
Fe+3 = V2 -V1 = V3
(1) حساب تركيز أيونات الحديدوز الثنائي Fe+2
– من معادلة التفاعل الموزونة:
Cr2O7-2 + 14H+ + 6Fe+2 ↔ 2Cr+3 + 6Fe+3 + 7H2O
نجد أن:
1mol K2Cr2O7 = 6mol Fe+2
– عدد مللي مولات الحديدوز = عدد مللي مولات ثاني كرومات البوتاسيوم
(K2Cr2O7) M × V = M × V (Fe+2)
– لكي يتم تكافؤ عدد مللي مولات سيتم ضرب مللي مولات الكرومات × 6 ، وضرب مللى مولات الحديدوز × 1 ويكون:
(K2Cr2O7) 6 (M × V) = 1 (M × V) (Fe+2)
(K2Cr2O7) 6 (0.05 × V1) = (M × 25) (Fe+2)
(Fe+2) = ??M
(Fe+2) = ??M
(2) حساب تركيز أيونات الحديديك الثلاثي Fe+3
بنفس الطريقة السابقة نجد أن:
(K2Cr2O7) 6 (M × V) = 1 (M × V) (Fe+3)
(K2Cr2O7) 6 (0.05 × V3) = (M × 25) (Fe+3)
(Fe+3) = ??M
تعليمات السلامة داخل المختبر الكيميائي
يجب عليك قبل بدء التجربة مراعاة الآتي:
(1) يجب مراعاة نظافة المختبر والأدوات المستخدمة به .
(2) يجب عدم إلقاء المواد الكيماوية بالأحواض إلا بعد تخفيفها ، ولا يجوز نهائيا إلقاء قطع أو قشور الصوديوم في الأحواض
(3) يجب أن تكون الأرضيات وكذلك أسطح الطاولات من مواد مقاومة للحريق والمواد الكيماوية وسهلة التنظيف .
(4) يجب غسل الأواني التي بها بقايا مواد سريعة الاشتعال بعد انتهاء العمل بها .
(5) يجب عدم تخزين الكيماويات أو عينات المواد المراد حفظها داخل المختبر إلا بأقل قدر ممكن ولحاجة العمل فقط .
(6) يجب عدم حفظ السوائل السريعة التبخر إلا في الثلاجات ويجب الانتباه عند تغطية زجاجات الكيماويات .
(7) يجب وضع إناء مملوء بالرمل تحت القناني التي لا يوجد سبيل آخر لحمايتها ، واعلم أن استخدام الرمال والتراب لامتصاص الأحماض المنسكبة على الأرض من الوسائل الآمنة من وجهة نظر السلامة .
(8)عند تسخين مواد سريعة الاشتعال يجب استخدام حمام مائي.
(2) يجب عدم إلقاء المواد الكيماوية بالأحواض إلا بعد تخفيفها ، ولا يجوز نهائيا إلقاء قطع أو قشور الصوديوم في الأحواض
(3) يجب أن تكون الأرضيات وكذلك أسطح الطاولات من مواد مقاومة للحريق والمواد الكيماوية وسهلة التنظيف .
(4) يجب غسل الأواني التي بها بقايا مواد سريعة الاشتعال بعد انتهاء العمل بها .
(5) يجب عدم تخزين الكيماويات أو عينات المواد المراد حفظها داخل المختبر إلا بأقل قدر ممكن ولحاجة العمل فقط .
(6) يجب عدم حفظ السوائل السريعة التبخر إلا في الثلاجات ويجب الانتباه عند تغطية زجاجات الكيماويات .
(7) يجب وضع إناء مملوء بالرمل تحت القناني التي لا يوجد سبيل آخر لحمايتها ، واعلم أن استخدام الرمال والتراب لامتصاص الأحماض المنسكبة على الأرض من الوسائل الآمنة من وجهة نظر السلامة .
(8)عند تسخين مواد سريعة الاشتعال يجب استخدام حمام مائي.
احتياطات أخرى
(9) لا تحاول أن تدخل بقوة أنبوبة في سدادة فلين أو مطاط ، بلل الزجاج بالماء أو الزيت أولاً لان ذلك يسهل ألي حد كبير هذه العملية .
(10) يجب تداول المواد الخطرة حسب الأسس العلمية ، وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه .
(11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر ، ومراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائيا حيث إنها تشتعل بمجرد تعرضها للهواء
(12) يجب أن يكون بكل مختبر أكثر من مخرج ويفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج
(13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يوميا ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة .
(14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه .
(15) يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر .
(16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وان تكون مزودة بمروحة سحب مناسبة .
(10) يجب تداول المواد الخطرة حسب الأسس العلمية ، وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه .
(11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر ، ومراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائيا حيث إنها تشتعل بمجرد تعرضها للهواء
(12) يجب أن يكون بكل مختبر أكثر من مخرج ويفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج
(13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يوميا ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة .
(14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه .
(15) يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر .
(16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وان تكون مزودة بمروحة سحب مناسبة .
المراجع: – كتاب تجارب في الكيمياء التحليلية (التحليل الكمي الحجمى والوزني) / مسعود فرج أبو سته / كلية العلوم – جامعة سبها
 تعرف على علم الكيمياء
تعرف على علم الكيمياء






لقد استفدت من التجربة