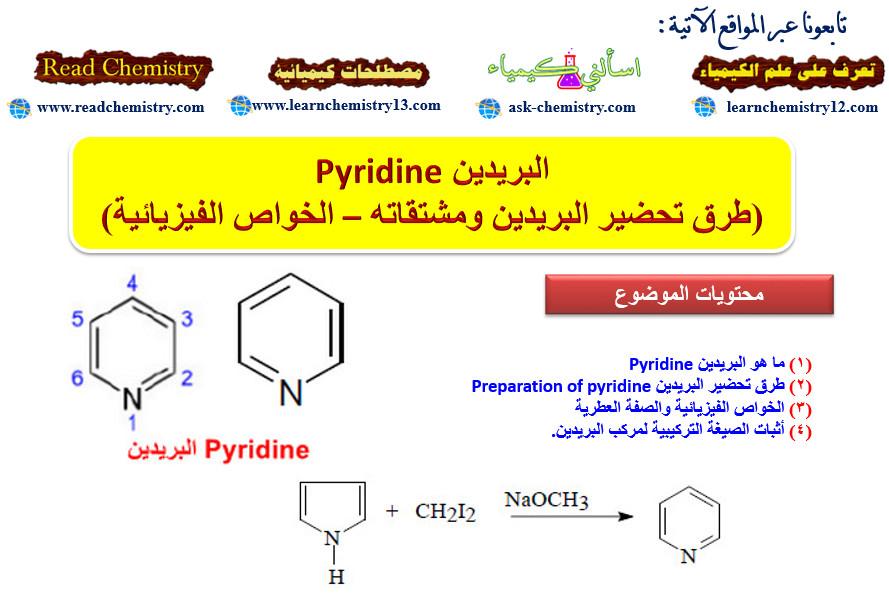
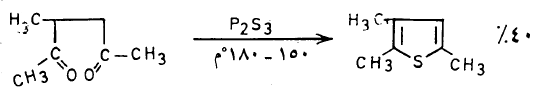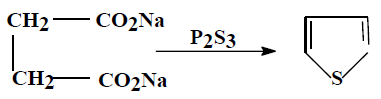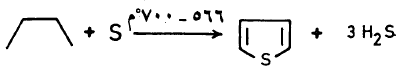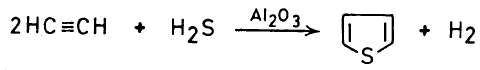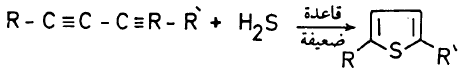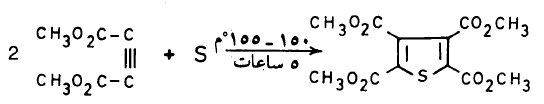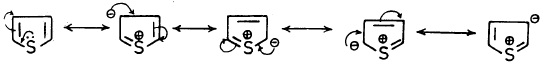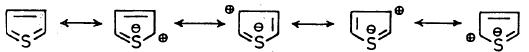الثيوفين Thiophene (طرق تحضير الثيوفين ومشتقاته – الخواص الفيزيائية)
في هذا الموضوع سيتم مناقشة مركب الثيوفين Thiophene طرق تحضيره ومشتقاته – الخواص الفيزيائية لهذا المركب. وفى الموضوعات القادمة سيتم مناقشة جميع التفاعلات الكيميائية له.
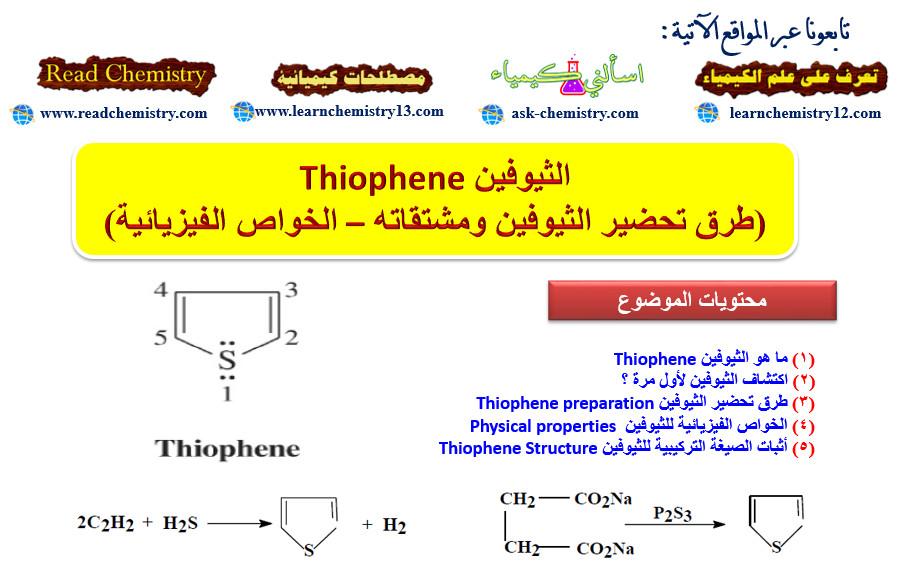
ما هو الثيوفين Thiophene
– هو مركب أروماتي خماسي الحلقة غير متجانس يحتوي على ذرة كبريت واحدة.
– يحدد مكان السلسة الجانبية أو المجاميع الفعالة على الحلقة بأعداد. ويجب أن تأخذ ذرة الكبريت رقم (1)
– يوجـد في قطران الفحم إلا أنه لا يوجد بشكل حر في الطبيعة.
– البنزين الناتج من تقطير قطران الفحم يحتوي على 0.5٪ من الثيوفين وذلك لتقارب درجة غليانها فالبنزين يغلي عند ٨٠مo بينما الثيوفين يغلي عند ٨٤مo كما أن درجة غليان مشتقاتها متقاربة.
اكتشاف الثيوفين لأول مرة
– اكتشف فيكتور ماير عام ١٨٨٢م وجود هذا المركب كمادة مصاحبة للبنزين عند تقطير قطران الفحم.
– ففي أول الأمر كان يظن أن اللون الأزرق الناتج من تسخين مادة الإزاتين ( lsatin) مع البنزين الناتج من قطران الفحم في وجود حمض الكبريتيك المركز هو كشف يدل على وجود البنزين.
– إلا أنه اكتشف خطأ اعتقاده عندما أجرى التجربة نفسها على بنزين نقي حضر من تسخين بنزوات الكالسيوم ولم يحصل على النتيجة نفسها مما جعله يستنتج أن اللون الأزرق لم يكن راجعاً إلى البنزين نفسه، بل إلى مادة أخرى موجودة معه أطلق عليها اسم الثيوفين.
– وقد أصبح تفاعل الثيوفين مع مادة الإزاتين من الاختبارات المميزة للثيوفين حيث تكون مادة الإندولين ذات اللون الأزرق.
طرق تحضير الثيوفين Thiophene preparation
(1) طريقة بال – كنور Pall – Knorr synthesis
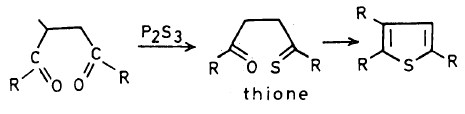
يمكن تحضير الثيوفين في المعمل عن طريق تسخين مركب 4,1۔ مجموعة الكربونيل مع ثالث كبريتيد الفسفور کما تبين ذلك المعادلات الآتية:
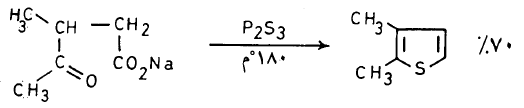
– وتسمى هذه الطريقة طريقة بال ـ نور
– وميكانيكية هذا التفاعل غير معروفة ولكنه يعتقد أن 4,1- ثنائي مجموعة الكربونيل تتفاعل ثالث كبريتيد الفوسفور وتتكون مادة متوسطة عبارة عن ثيون ( Thione) تفقد جزيء ماء لتكون مشتق الثيوفين.
يمكن بنفس الطريقة تحضير الثيوفين من تسخين سكسينات الصوديوم مع ثالث كبريتيد الفوسفور كالتالي:
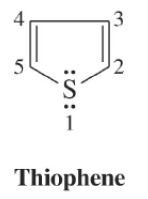
(2) حرق البيوتـان أو البيوتين أو البيوتادايين مع الكبريت
– يحضر Thiophene تجارياً من حرق البيوتـان أو البيوتين أو البيوتـادايين مع الكبريت.
– حيث يسخن الخليط عند درجة حرارة عالية ولمدة قصيرة تصل إلى ثانيتين وتصل نقاوة الناتج بعد التقطير إلى 99٪.
(3) تفاعل الأسيتيلين وكبريتيد الهيدروجين في أنبوب ساخن
– كما أنه يمكن تحضير Thiophene بإمرار خليط من الأسيتيلين وكبريتيد الهيدروجين في أنبوب ساخن في وجود عامل مساعد مثل الألوميناAl2O3
– تعتبر هذه الطريقة طريقة تجارية لتحضير الثيوفين.
(4) تفاعل ثنائي الأسيتيلين مع كبريتيد الهيدروجين في وجود قاعدة ضعيفة
– يمكن تحضير Thiophene أو مشتقاته بتفاعل ثنائي الأسيتيلين مع كبريتيد الهيدروجين في وجود قاعدة ضعيفة.
ؘR ، R يمكن أن تكون مجموعة الكيلية أو هيدروجين أو مجموعة أريلية أو كربوكسيلية أو غيرها.
– ويتم الحصول على ناتج أفضل عند استخدام الطريقة التالية:
الخواص الفيزيائية للثيوفين Physical properties of Thiophene
(1) هو مركب سائل عديم اللون ثابت.
(2) درجة غليانه مشابه تقريباً لدرجة غليان البنزين حيث يغلي البنزين عند 80 مo ، بينما الثيوفين يغلي عند 84 مo
(3) الثيوفين ومشتقاته يشبه البنزين ومشتقاته في كثير من الخواص مثل درجة الغليان وكذلك الرائحة.
(4) كثافته أكبر من كثافة من البنزين بقليل حيث إن له كثافة تقدر بـ 1.058 جم/سم3.
(5) يذوب في أغلب المذيبات العضوية لكنه لا يذوب في الماء.
أثبات الصيغة التركيبية للثيوفين Thiophene Structure
– أثبتت الدراسات المختلفة أن للثيوفين:
(1) أطوال الروابط فيه وسط بين أطوال الروابط الأحادية والثنائية.
(2) يوجد به ستة إلكترونات: واحد من كل ذرة كربون والكترونان من الذرة غير المتجانسة (الكبريت) في حالة دوران داخل الجزء مما يشكل سحابة إلكترونية تسمى سحابة باي (π-Cloud)
(3) الثيوفين له عدة صيغ تأرجحية (رنينية) ناتجة عن تراكب مدارات 3P في الكربون مع مدار 3P في الكبريت.
هذه الصيغ التأرجحية لها طاقة تأرجح تقدر بحوالي 31 ك سعر/جزيء.
ويمكن تمثيل هذه الصيغ كما يلي:
(4) نتيجة لكون الفرق في الطاقة بين مدارات 3P ومدارات 3d صغير جداً فإن الثيوفين يستطيع أن يكون صيغا تأرجحية ناتجة عن تراكب مدارات 3P في الكربون مع مدار 3d في الكبريت.
وهذه الصيغ التأرجحية يمكن أن تأخذ الشكل التالي:
ومن الصيغ التأرجحية للثيوفين يتضح أن موضعي 2- أو 5- لديها كثافة إلكترونية اعلى من تلك التي عند موضعي 3- أو 4-، هذا ما يجعل موضعي 2- أو 5- أكثر عرضة للهجوم بواسطة العوامل الإلكتروفيلية من الموضعين الآخرين، والذين بدورهما أكثر فعالية من البنزين لكل من العوامل الإلكتروفيلية والشقوق الحرة.
نستنتج من ذلك أن الثيوفين عبارة عن مركب أروماتي طاقته التأرجحية أعلى من تلك التي للبيرول أو الفيوران. وهذا يتفق مع كهروسالبية الذرة غير المتجانسة أي أن الصفة العطرية تكون حسب الترتيب التالي:
كما أن الصيغ التأرجحية توضح أن الكثافة الإلكترونية متمركزة على موضعي 2- و 5- مما يجعـل تـفـاعـلات الاستبدال الإلكتروفيلية تفضل هذين الموضعين على حساب موضعی 3- و 4 – .
المراجع:
- كتاب المركبات الحلقية غير المتجانسة والحيوية للدكتور حمد بن عبدالله اللحيدان والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب – الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية
- محاضرات 341 كيم كيمياء المركبات الحلقية غير المتجانسة Chemistry of Heterocyclic Compounds للدكتور عبدالله بن محمد الماجد – جامعة الملك سعود – السعودية
- كتاب الكيمياء العضوية للمؤلف د. حسن محمد الحازمي / الجزء الثاني