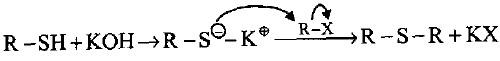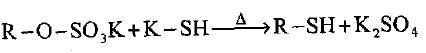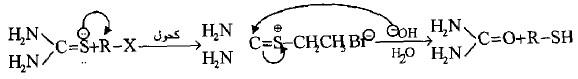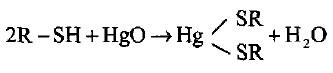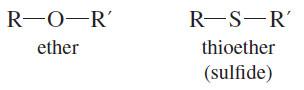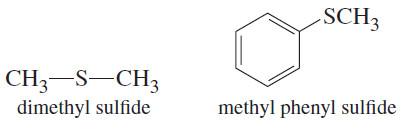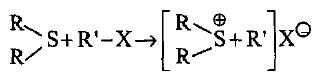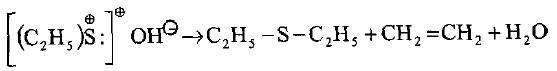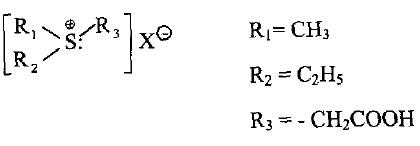الثيولات Thiols – الايثرات الكبريتية Thioethers
أولاً/ الكحولات الكبريتية Thioalcohols, Mercaptans (الثيولات)
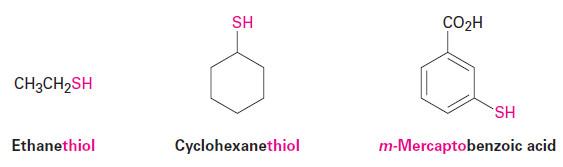
– الكحولات الكبريتية Thioalcohols أو الثيولات Thiol هي المركبات المشابهة للكحولات وتعتبر المشتقات الأحادية الألكيلية لكبريتيد الهيدروجين – حيث تدعى المجموعة H – SH مجموعة مركابتو سلفها يدريل أو ثايول.
تحضير الثيولات (الكحولات الكبريتية)
– تحضر الكحولات الكبريتية بالطرق التالية كما يلي:
(1) عند تسخين هاليدات الألكيل مع كبريتيد البوتاسيوم الحامضي (KOH+H2S) في مذيب الايثانول فان الناتج هو الكيل مركبتان وهذه المركبات تتميز بدرجات غليان واطئة مقارنة مع الكحولات المقابلة لها.
– تتميز الثايولات بالصفة الحامضية +R-S–H في الوسط القاعدي المستخدم لذا يجب زيادة كمية غاز ثاني كبريتيد الهيدروجين للحصول على الثايول وإلا فان التفاعل سيستمر لإعطاء الايثر المقابل (R-O-R).
(2) إذا تم تعريض المحلول المائي لملح بوتاسيوم الكبريتات الألكيلية إلى التقطير مع كبريتيد البوتاسيوم الحامضي فأن الناتج سيكون الكحول الكبريتي المقابل.
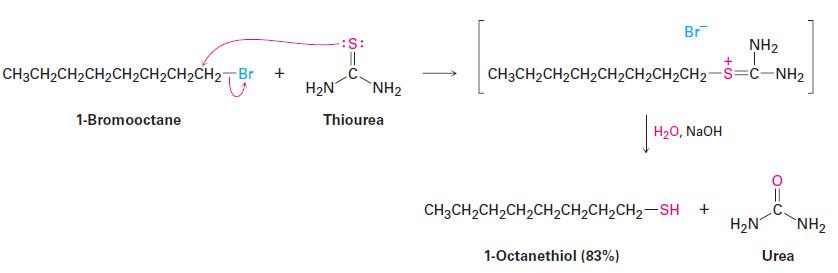
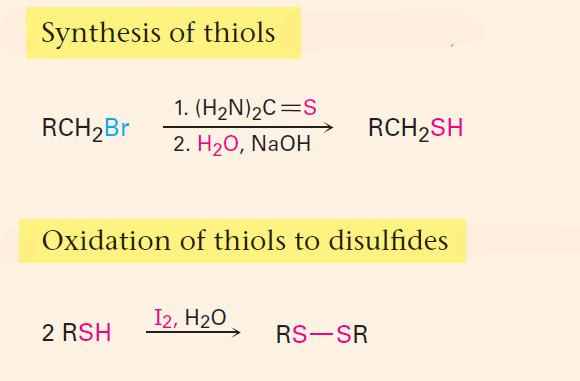
(3) تتفاعل هاليدات الألكيل مع مركب الثايوريا لتكوين أملاح S- الكيل ثيورونيوم تتمتع باستقرارية واضحة ولكنها تتحلل في الوسط القاعدي لإنتاج الثايول المقابل وتكوين اليوريا.
خواص الثيولات
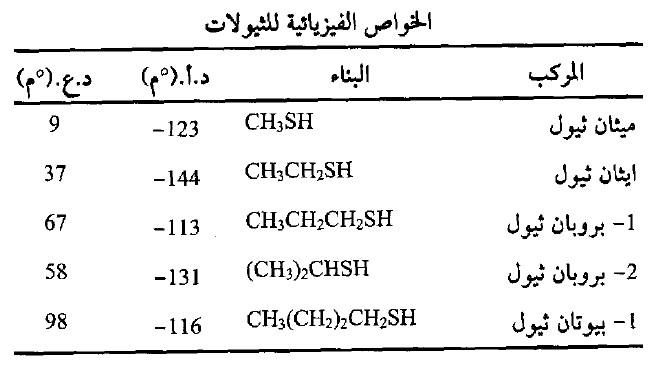
– الثيولات سوائل ذات درجات غليان واطئة لأنها تكون روابط هيدروجينية ضعيفة قياساً بالماء والكحولات.
– تتواجد هذه المركبات في بعض الحوامض الأمينية مثل السستين (Cystine) والسيستين (Cysteine) كما توجد في البصل والثوم.
– تكون رائحة هذه المركبات كريهة سيما المركبات ذات الوزن الجزيئي الواطيء.
– نظراً لقطبيتها العالية فأنها تعتبر أقوى حامضية من الكحولات المقابلة وبذلك تكون أقوى نيوكليو فيلية من آيون الأيثوكسيد.
– أملاح الثايولات وتدعي المركبتيدات (Mercaptides) هي أقل قابلية للتحلل المائي مقارنة بالأيثوكسيدات مثل أملاح الزئبق غير الذائبة.
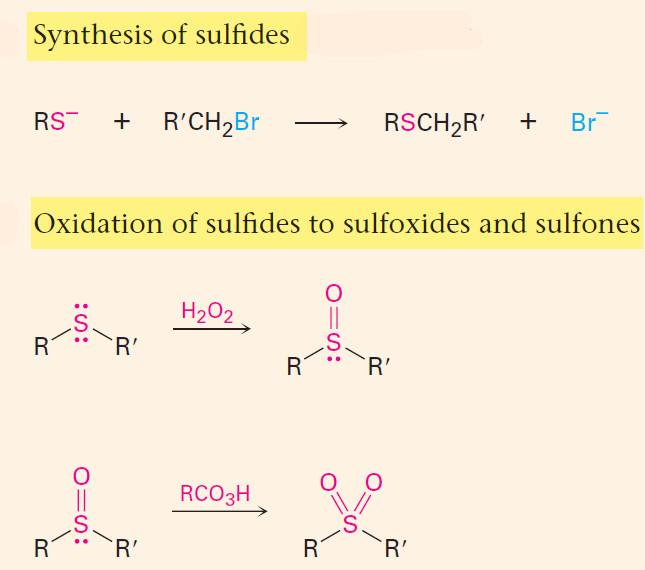
– تتشابه مركبات الثايول مع غاز كبريتيد الهيدروجين في تأكسدها البطيء بالهواء الجوي لإعطاء ثنائي الكبريتيد.
– أما العوامل المؤكسدة القوية مثل حامض النتريك المركز فأنه يحول مركبات المركبتان إلى الحوامض السلفونية الألكيلية المقابلة كما بالمعادلة التالية:
– إليك الملخص التالي كما يلي:
ثانياً/ الايثرات الكبريتية Thioethers
– الايثرات الكبريتية (الثايو ايثرات Thioethers) الكبريتيدات ثنائية الألكيل dialky sulphides هي المركبات المشابهة للايثرات الاعتيادية والتي تعتبر مشتقات غاز كبريتيد الهيدروجين باستبدال ذرتي الهيدروجين بمجموعتي الكيل متشابهة أو مختلفة.
– فإذا كانت المجموعتين متشابهتين سمي الثايوايثر بسيطاً (Simple) أما إذا اختلفت المجموعتين كان الثايوايثر مختلطاً (mixed).
– كذلك الايثرات الكبريتية سوائل ذات رائحة نفاذة وتكون عديمة الذوبان في الماء.
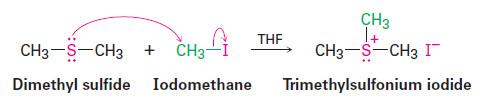
– كما تكون مع الهالوجينات شبه أملاح في تفاعلات إضافية، وكذلك مع هاليدات الألكيل وأملاح الفلزات وغيرها.
– مقارنة مع أملاح الأوكزونيوم تدعى هذه الأملاح بأملاح السلفونيوم مثل ثلاثي الكيل هاليدات السلفونيوم والتي يمكن الحصول عليها من تفاعل الثايوايثرات مع هاليدات الألكيل أو أملاح الأوكزونيوم الثالثية على شكل بلورات مستقرة جداً.
– العلاقة بين روابط هذا المركب تكاد تكون متشابهة مع أملاح الأوكزونيوم حيث أن ذرة الكبريت تكون ثلاثية التكافؤ مع شحنة +1، بالإضافة إلى الروابط التساهمية الثلاث ورابطة تساندية كهربائية.
– أن هيدروكسيدات السلفونيوم التي يمكن الحصول عليها من تفاعل هيدروكسيد الفضة مع يوديدات السلفونيوم تكون قواعد قوية والتي تتفكك إلى الايثرات الكبريتية والأولفين والماء.
– تكون أملاح السلفونيوم بمجاميعها مهيئة للفصل إلى أندادها.
– هذا يعني أن ذرة الكبريت تكون مركزاً للهرم الرباعي بين مجاميعها وأن المزدوج الإلكتروني غير المرتبط في زاوية الهرم الرباعي يعوض مكان أو وظيفة مجموعة في ذرة الكربون غير المتناظرة (الكيرالية).
– إليك الملخص التالي كما يلي:
المراجع
- الكيمياء العضوية الإليفاتية – د/ عادل شاكر الطائي – دار المسيرة للنشر والتوزيع – عمان – الأردن – 2009
- Organic chemistry / L.G. Wade, Jr / 8th ed, 2013 / Pearson Education, Inc. USA
- Unergraduate Organic Chemistry /Dr. Jagdamba Singh, Dr. L.D.S Yadav / 1st ed, 2010/ Pragati prakashan Educational Publishers, India.
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States