التنجستن Tungsten – الخواص الفيزيائية والكيميائية
محتويات الموضوع
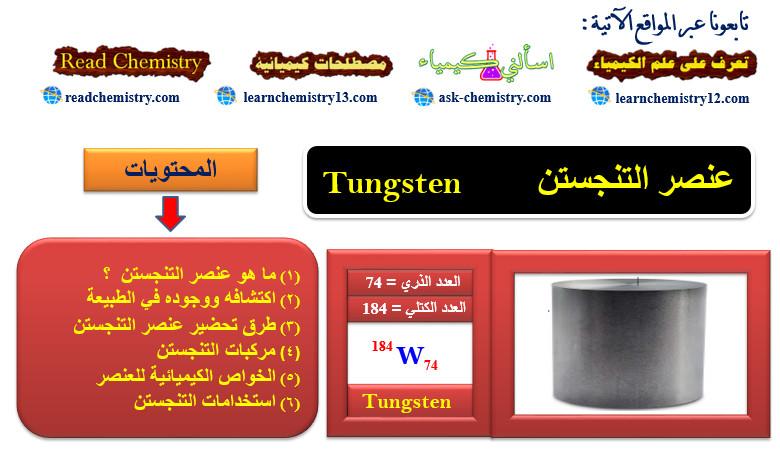
ما هو عنصر التنجستن Tungsten؟
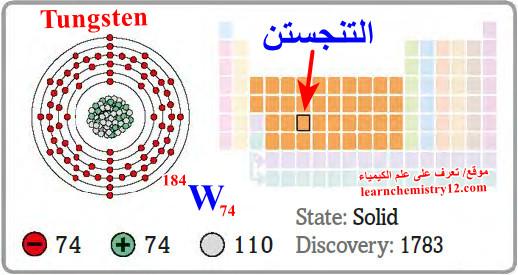
– التنجستن Tungsten هو عنصر من عناصر الجدول الدوري: العدد الذري = 74، العدد الكتلي = 184
– الرمز الكيميائي لعنصر التنجستن يرمز له بالرمز: 184W74
– التوزيع الإلكتروني له: Xe]54 6s2 4f14 5d4]
– التنغستن فلز انتقالي، صلب ذو لون رمادي، سهل القصف وصعب التطويع.
– ولكن يمكن التعامل معه بسهولة في حالات الصهر والتشكيل إذا كان نقياً.
– يتمتع التنغستن النقي من بين جميع الفلزات بأعلى درجة انصهار وأعلى قوة شد فهو يتحول إلى سائل عند درجة حرارة شديدة تبلغ 3414 درجة مئوية (6177.2 درجة فهرنهايت).
– ولكنه يملك أخفض معامل تمدد حراري وكذلك أخفض ضغط بخار.
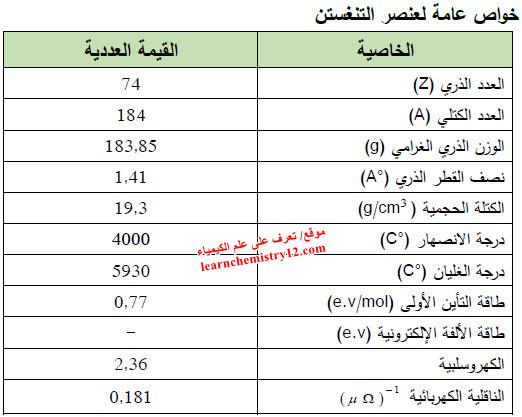
– الجدول التالي يوضح الخواص العامة لعنصر التنجستن كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Tungsten
– اكتشف التنغستن من قبل الأخوين (دون فوستو) و (دون دوان دولهويار) عام 1783م حيث نجحا في عزله بواسطة فحم الخشب ونالا سمعة مرموقة بسبب اكتشاف هذا العنصر.
– كلمة تنجستن تعني بالسويدية (الحجر الثقيل)، وكان يسمى قديماً (ولفرام wolfram) وهذا هو الأصل في اعتماد صيغته الكيميائية لهذا العنصر بالرمز (W)
– عادة يتم الحصول عليه من خام الولفراميت wolframite وهو المصدر الرئيسي للتنغستن النقي. وهو خام معدني داكن يحتوي على التنجستن والحديد.
– يوجد التنجستن بنسبة 4–10% من القشرة الأرضية على شكل خام الشيليت (CaWO4) وخام الولفراميت wolframite المكون من مركبين الأول الفيربريت ( TeWO4) والثاني الهوبرنيت ( MnWO4).
تحضير التنجستن Preparation of Tungsten
– يحضر التنجستن بطريقتين: طريقة حمضية وأخرى أساسية حيث نستعمل في ذلك خام الولفراميت [Fe,Mn) WO4)]
– نتحصل في كل من الطريقتين على أكسيد التنغستن السداسي بالهيدروجين فنتحصل على مسحوق معدن التنجستن.
– تكون معادلات التفاعل للطريقتين كما يلي:
مركبات التنجستن Tungsten Compounds
(1) أكاسيد التنجستن
– ثاني أكسيد التنجستن هو مركب رباعي التكافؤ صيغته WO2 تتشكل كما بالتفاعل التالي:
WO3 + H2 → WO2 + H2O
– ثلاثي أكسيد التنغستن WO3 الأصفر ويتكون نتيجة اتحاد التنغستن مع الأكسجين بشكل نموذجي كما بالتفاعل التالي:
W + 3/2 O2 → WO3
– خماسي أكسيد التنغستن ينتج من اتحاد ثلاثي أكسيد التنغستن مع الهيدروجين كما بالتفاعل التالي:
2WO3 + H2 → W2O5 + H2O
(2) كربيدات التنجستن
– يعرف له الكربيدين WC , W2C وينتجان عن تسخين مسحوق التنجستن مع الكربون.
– يعدان من أقسى الكربيدات.
– كذلك يعد WC ناقلاً كهربائياً فعالاً، أما W2C فهو أقل ناقلية منه.
– يسلك كربيدا التنجستن سلوكاً مشابهاً لسلوك التنجستن الحر وهما مقاومان للهجوم الكيميائي، في أنهما يتفاعلان بقوة مع الكلور ليشكلا سداسي كلوريد التنغستن WCl6
(3) مركبات أخرى
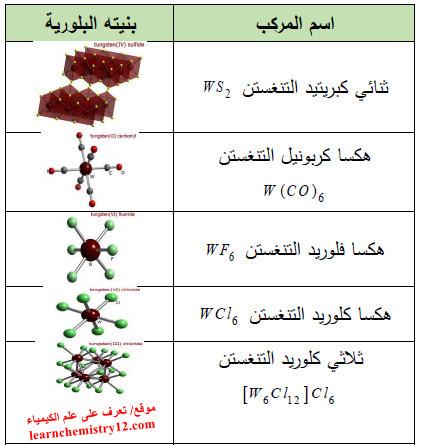
– كذلك توجد الكثير من المركبات الأخرى لعنصر التنغستن كما بالجدول التالي:
الخواص الكيميائية لعنصر التنجستن Chemical properties of Tungsten
(1) التفاعل مع الهواء
– في درجة حرارة الغرفة، التنجستن لا يتفاعل مع الأكسجين، إلا أنه عند التسخين فإنه يتفاعل معه لتشكيل ثلاثي أكسيد التنغستن كما بالتفاعل التالي:
2W (s) + 3O2 (g) → 2WO3 (s)
(2) التفاعل مع الهالوجينات
– في الشروط العادية يتفاعل التنجستن مع الفلور لتكوين سداسي فلوريد التنغستن كما بالتفاعل التالي:
عديم اللون W(s) + 3F2 (g) → WF6 (g)
– أما عند درجة الحرارة 250م فإنه يتفاعل مع الكلور والبروم ليشكل على التوالي سداسي كلوريد التنغستن وسداسي بروميد التنجستن كما بالتفاعلات التالية:
أزرق داكن (W(s) + 3Cl2 (g) → WCl6 (s
أزرق داكن (W(s) + 3Br2 (g) → WBr6 (s
– وفي شروط معينة يمكن له أن يتفاعل مع الكلور لتشكيل خماسي كلوريد التنغستن كما بالتفاعل التالي:
أخضر داكن (2W(s) + 5Cl2 (g) → 2WCl5 (s
استخدامات التنجستن Uses of Tungsten
(1) نظراً لحفاظه على قوته في درجات حرارة عالية ونقطة انصهاره العالية، فهو يستخدم في العديد من التطبيقات مثل: فتائل مصابيح الإضاءة، أنابيب الإشعاع الكاثودي، أنابيب التفريغ، عناصر تجهيزات التدفئة وفوهات محركات الصواريخ.
(2) كما يستخدم في الإلكترونيات كمادة توصيل في المدارات التكاملية بين مواد ثاني أكسـيد السيليكون العازلة والترانزستورات.
(3) نظراً لتماثل معاملي التمدد الحراري للتنغستن والزجاج فهو يستخدم في تلحيم المعادن بالزجاج.
(4) تستخدم السبائك عالية الكثافة من التنغستن، النيكل النحاس والحديد في صنع السهام ذات المواصفات العالية للحصول على تجهيزات قتالية ذات أقطار صغيرة وإحكام دقيق.
(5) كذلك يستخدم التنجستن في صناعة المجوهرات بدلاً من الذهب والبلاتين.
(6) تستخدم مركبات التنغستن كمحفزات كيميائية وصبغات لا عضوية مثل أكاسيد التنغستن، أما كربيد التنغستن يستخدم في تصنيع أدوات الحك، السكاكين، ريش المثقب، المناشير وأدوات الخياطة في ورشات المعادن والأخشاب وفي مناجم النفط والبناء.
(7) يستخدم أكاسيد التنجستن في طلي السيراميك بطبقة لامعة، بينما أملاحه فتستخدم في الصناعات الكيميائية والدباغة.
(8) علاوة على ذلك تسمح نقطة انصهار التنجستن العالية باستخدامه في خيوط المصابيح الكهربائية ولكن أصبحت أقل شعبية لأنها ليست موفرة للطاقة.
(9) هذا العنصر مفيد أيضاً في إنتاج الأوزان، مثل الغطاسات المستخدمة مع طُعم الصيد ويفضل غاطس التنغستن على الرصاص لأنه غير سام.
(10) يتم استخدام مركب يسمى كربيد التنغستن لتصلب الأجسام مثل لقم الثقب، مما يحميها من التلف.
(11) كانت أصباغ التنجستن مستخدمة في الخزف الصيني منذ 350 عامًا.
تأثير التنجستن على البيئة
– يعد التنجستن أثقل عنصر معروف تستخدمه المتعظيات الحية، وهو مغذ أساسي لبعض البكتيريا، فعلى سبيل المثال: يستخدم في الإنزيمات المسمات خمائر (مؤكسدة – مرجعة) بشكل مماثل لاستعمال المولييدنيوم، من خلال دخوله في معقد تنجستن – بتيرين.
(بتيرين: هو مركب حلقي لا متجانس لحلقة البيرازين وحلقة البيريميدين التي تتضمن كربونيل أكسجين ومجموعة أمينو).
– تقوم الإنزيمات الحاوية على التنجستن بإختزال الأحماض الكربوكسيلية الحرة إلى ألدهيدات.
– لقد تمت دراسة التنجستن كمضاد للأثر البيولوجي للنحاس، فوجد أن المركب رباعي ثيو تنغستات يمكن أن يستخدم كمادة كيميائية لتعقيد النحاس بيولوجياً بدور مشابهاً لرباعي ثيو موليبيدات.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017