السترونشيوم Strontium – الخواص الفيزيائية والكيميائية له
محتويات الموضوع
ما هو عنصر السترونشيوم Strontium؟
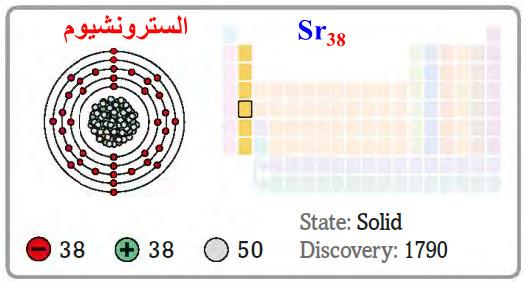
– السترونشيوم Strontium هو عنصر من عناصر الجدول الدوري: العدد الذري = 38 ، العدد الكتلي = 88
– الرمز الكيميائي لعنصر السترونشيوم يرمز له بالرمز: 88Sr38
– التوزيع الإلكتروني له: Kr]36 5s2]
– السترونشيوم عبارة عن معدن ذي لون أبيض فضي يزول هذا اللون بالتعرض للهواء نتيجة تأكسده.
– كما يتمتع هذا المعدن بناقلية جيدة للحرارة والكهرباء، كما يتميز بالفعالية والكهروإيجابية المرتفعة.
– يشكل السترونشيـوم تحت الدرجة 215 مo بلورات من نموذج المكعبي متمركز الوجه (Fcc) ولكن عند درجات أعلى يشكل نماذج مختلفة.
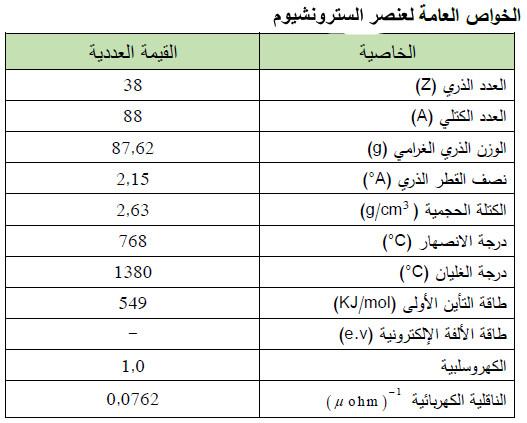
– الجدول التالي يوضح الخواص العامة لعنصر السترونشيوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Strontium
– تم اكتشاف السترونشيوم في عام 1791م في معدن تم العثور عليه بالقرب من قرية سترونتيان Strontian الأسكتلندية.
– احترق المعدن بلهب قرمزي لامع، ودرسه الكيميائي الأسكتلندي توماس تشارلز هوب ووجد أنه يحتوي على عنصر جديد.
– كان هذا المعدن يسمى السترونتيانيت Strontianite، وهو خام رئيسي من السترونشيـوم.
– تم استخراج السترونشيـوم النقي لأول مرة بواسطة الكيميائي البريطاني همفري ديفي عام 1808م ، الذي أجرى تجربة باستخدام الكهرباء للحصول على العنصر من المعدن.
– اشتق اسمه من اسم المدينة الأسكتلندية (Strontian).
– كما لا يوجد هذا العنصر بشكل حر في الطبيعة وذلك لشدّة فعاليته، ولكن فلزاته واسعة الانتشار في اليابسة ومياه البحر.
– بالإضافة ألى ذلك فأن أهم خاماته بشكل كربونات السترونشيـوم SrCO3 وكبريتات السترونشيـوم SrSO4.
طرق تحضير السترونشيوم Preparation of Strontium
– يحضر السترونشيوم بالتحليل الكهربائي لمصهور كلوريد السترونشيوم.
– يستعمل معه فلوريد السترونشيـوم لتخفيض درجة انصهار SrCl حيث يوضع المزيج الملحي في قارب من الحديد المبطن بالغرافيت الذي يشكل المصعد.
– أما المهبط وهو عبارة عن قضيب حديدي يغمس في مصهور المزيج الملحي حيث يرتفع هذا المهبط مع تشكل قضيب من السترونشيـوم.
– كما يمكن أن يحضر باختزال هاليد السترونشيـوم بالصوديوم.
الخواص الكيميائية لعنصر السترونشيوم Chemical properties of Strontium
(1) التفاعل مع الأكسجين
– يتفاعل السترونشيوم مع الأكسجين بالتسخين ويتشكل أكسيد SrO كما بالمعادلة الآتية:
2Sr + O2 → 2SrO
– وعند تسخينه في الهواء يتشكل الأكسيد والنتريد معاً Sr3N ، SrO
(2) التفاعل مع الماء
– يتفاعل Sr بسهولة مع الماء وينطلق غاز الهيدروجين كما بالمعادلة الآتية:
Sr + 2H2O → Sr(OH)2 + H2
(3) التفاعل مع الهيدروجين
– كما يتفاعل Sr بالتسخين مع الهيدروجين ويتشكل هيدريد السترونشيـوم وهو مركب ثابت في الشروط الطبيعية كما بالمعادلة الآتية:
Sr + H2 → SrH2
(4) التفاعل مع أشباه المعادن
(أ) النيتروجين
– يتفاعل السترونشيوم مع النيتروجين بالتسخين إلى درجات مناسبة ويشكل نتريد السترونشيوم ذو الصيغة Sr3N2 وهو مركب يتحلمه بسرعة في الماء ويتشكل هيدروكسيد السترونشيـوم وينطلق غاز النشادر كما بالمعادلة الآتية::
Sr3N2 + 6H2O → 3Sr(OH)2 + 2NH3
(ب) الكربون
– يتفاعل Sr مع الكربون بالتسخين ويتشكل كربيد أو استيليد السترونشيوم ذو الصيغة SrC2 وتتصف هذه المركبات بأنها تحلل بالماء وتشكل هيدروكسيد السترونشيـوم وتطلق غاز الأستيلين كما بالمعادلة الآتية:
SrC2 + 2H2O → Sr(OH)2 + C2H2
(جـ) الفوسفور
– يتفاعل Sr مع الفوسفور بالحرارة ويتشكل فوسفيد السترونشيـوم ذو الصيغة Sr3P2 والذي يتحلمه بسرعة بالماء ويتشكل هيدروكسيد السترونشيـوم وينطلق غاز الفوسفين كما بالمعادلة الآتية:
Sr3P2 + 6H2O → 3Sr (OH)2 + 2PH3
(د) الهالوجينات والكبريت
– يتفاعل Sr مع الهالوجينات جميعها ويتشكل هاليد السترونشيـوم SrX2
– كذلك يتفاعل مع الكبريت ويتشكل كبريتيد السترونشيـوم الذي يتحلل بالماء ويطلق غاز كبريتيد الهيدروجين.
(5) التفاعل مع الأحماض
يتفاعل السترونشيوم مع الأحماض مثل HCl و H2SO4 وينطلق غاز الهيدروجين كما بالمعادلة الآتية:
Sr + 2H+ → Sr2++ H2
استخدامات السترونشيوم Uses of Strontium
(1) كان السترونتيوم سابقاً يستخدم في شاشات التلفزيون، ولكن اليوم هناك استخداماته أقل في هذا المجال.
(2) كما ينتج أكسيد السترونشيوم في الفخار وطلاء الخزف ألوانًا مميزة، بينما تنتج كربونات السترونتيوم لونًا أحمر في المشاعل والألعاب النارية.
(3) يمكن جعل المغناطيسات التي تحتوي على أكسيد الحديد أقوى عن طريق إضافة السترونشيوم إليها. تستخدم هذه المغناطيسات القوية في مكبرات الصوت وأفران الميكروويف.
(4) كما يضاف كلوريد السترونتيوم إلى بعض أنواع معجون الأسنان.
(5) يعد السترونشيوم المشع مصدرًا للكهرباء لمحطات الرادار radar stations في الأماكن النائية حيث لا توجد خطوط كهرباء أو إمدادات وقود.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.