النحاس Copper – الخواص الفيزيائية والكيميائية للنحاس
محتويات الموضوع
ما هو عنصر النحاس Copper؟
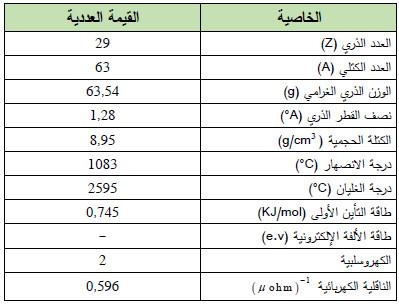
– النحاس Copper عنصر من عناصر الجدول الدوري: العدد الذري = 29 ، العدد الكتلي = 63
– يرمز لعنصر النحاس له بالرمز: 63Cu29
– التوزيع الإلكتروني له: Ar]18 4s1 3d10]
– النحاس عبارة عن فلز محمر اللون يتغير لونه وخصائصه عندما يتحد مع عناصر أخرى مشكلاً مركبات مختلفة.
– يتواجد في الطبيعة في عدة صور إما منفرداً أو متحداً على سبيل المثال أكاسيد النحـاس مادة لينة قابلة للطرق، تتفاعل كيميائياً أو فيزيائياً مع المصدر الخارجي (O2) مكوناً الصدأ.
– كما يعد ناقلاً جيداً للكهرباء والحرارة.
– الجدول التالي يوضح الخواص العامة لعنصر النحاس كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Copper
– اكتشف في الشرق الأوسط منذ 3500 سنة قبل الميلاد.
– وفي سنة 3000 قبل الميلاد تم إضافة القصدير له للحصول على برونز أشد صلابة.
– اشتق اسمه من اللاتينية Cuprium، اسم جزيرة Chypre حيث وجد أول أثر لاستغلاله.
– يعتبر النحاس من المعادن المتوسطة الانتشار في الطبيعة، وهو يشكل 0,012% من وزن القشرة الأرضية.
– كما يوجد النحاس الطبيعي النقي بجانب البحيرات لكن أكثره يوجد في بعض المناجم.
– ومن أهم خاماته البيريت CuFeS2 والتي تحتوي على 50% من النحـاس، والكالكوسيت Cu2S والكوبريت Cu2O2.
طرق تحضير النحاس Preparation of Copper
– يحضر النحاس من أكاسيده باختزالها بواسطة الفحم.
– كما أنه يحضر بكمية أكبر من كبريتاته التي تحتوي على فلز الحديد.
– إذ يؤخذ حوالي 250 طناً تضاف السيليكا إلى النحـاس المركز، ثم تسخن في فرن تحت ضغط منخفض وبدرجة حرارة تصل إلى 1400مo
– وعندما ينصهر FeS يتحول إلى الأكسيد بشكل أسرع من Cu2S وهكذا.
– وبإضافة السليكا يتضوع بأسفلها كبريتيد النحـاس والحديد.
– يوضع السائل في محلول يحوي السليكا ويمرر تيار من الهواء خلال المخلوط فيعمل على تحويل المتبقي من FeS إلى FeO ثم إلى الفلز، بينما Cu2S يتحول إلى Cu2O ثم إلى فلز النحـاس وفق المعادلات الآتية كما يلي:
2FeS + 3O2 → 2FeO + 2SO2
2Cu2S + 3O2 → 2Cu2O + 2SO2
– تتم تنقية النحاس بالطريقة الإلكترو كيميائية، ثم يفصل النحـاس من محلول التحليل الكهربائي المكون من CuSO4 على هيئة شريحة نحـاس نقية وترسب الشوائب.
الخواص الكيميائية للنحاس Chemical properties of Copper
(1) التفاعل مع الأكسجين
– يتفاعل النحاس بالتسخين في جو من الأكسجين ويتشكل أكسيد النحـاس كما يلي:
2Cu + O2 → 2CuO
– لكن النحاس يميل إلى تكوين الأكسيد (Cu2O) عند تسخينه إلى 1000مo حسب التفاعل الأتي كما يلي:
4Cu + O2 → 2Cu2O
(2) التفاعل مع الكبريت
– يتفاعل النحاس مع الكبريت ليشكل كبريتيد النحـاس حسب التفاعل الآتي كما يلي:
Cu + S → CuS
– وعند التسخين يتشكل:
2Cu + S → Cu2S
(3) التفاعل مع الأحماض
– يتفاعل النحاس مع الأحماض المركزة مثل: HNO3, H2SO4 مع انطلاق غاز الهيدروجين كما بالمعادلة الآتية:
Cu + 2HNO3 → Cu(NO3)2 + H2
– يتفاعل النحـاس كذلك مع حمض H2SO4 المخفف في وجود الأكسجين كما بالمعادلة الآتية:
2Cu + 2H2SO4 + 2O2 → 2CuSO4 + 2H2O
(4) التفاعل مع الهالوجينات
– يتفاعل النحاس مع الهالوجينات فتتشكل مركبات الهاليدات حسب التفاعل العام كما بالمعادلة الآتية:
Cu + X2 → CuX2
استخدامات النحاس Uses of Copper
يعتبر النحـاس مصدر مهم في حد ذاته ولذلك تعددت استعمالاته كما يلي:
(1) صناعة الكهرباء
– يستخدم في الصناعة الكهربائية لأنه ليس باهظ الثمن مثل صناعة المولدات الكهربائية وكابلات توصيل الكهرباء.
– بما أنه شديد المقاومة للمحاليل الكيميائية والتوصيل الحراري والكهربائي استعمل في المباني والمنشآت الكيميائية وأنابيب التدفئة والمنازل.
(2) اللحام
– تستعمل في الآلات الموسيقية النحاسية مثل الأجهزة والأبواق التي يتم لحامها بالزنك والنحـاس.
– كما تستعمل أيضاً في صناعة المجوهرات والأسلحة وفي الحرف اليدوي.
(3) الغذاء
– وجد أن غذاء الإنسان العادي يحتوي ما بين (2-5) مجم من النحـاس يومياً.
– يستخدم في الاختبارات التحليلية لصناعة السكر.
(4) السبائك
– يخلط النحاس مع عدد كبير من المعادن الأخرى لإنتاج أكثر من 1000 سبيكة مختلفة لكل منها صفات صناعية تختلف باختلاف المعادن ومن أهم هذه السبائك كما يلي:
(أ) سبيكة البرونز
– وهي من أهم السبائك، تتميز بالشدة والصلابة والمقاومة العلية للاحتكاك والاحتفاظ بجودته لمدة طويلة.
– كما تستخدم في صناعة الأسلحة مثل السيوف والرماح
– وعندما يضاف إلى السبيكة نسبة من الرصاص تزيد أغراض استعماله.
(2) سبيكة النحاس والنيكل والزنك
– تستخدم كأساس لتغطية آنية الطعام مثل الطباق والملاعق والسكاكين بطبقة فضية اللون وفي طلاء المجوهرات.
(3) سبيكة البرونز والنحاس والألمنيوم
– تتميز هذه السبيكة بالمقاومة الشديدة للتفاعلات وتستخدم في المصافي ومعامل تكرير الملح.
تأثير النحاس على جسم الإنسان
– يدخل في تركيب الكثير من الإنزيمات، وبذلك يحافظ على نشاط وصحة القلب والعظام والأعصاب والدماغ والكريات الحمراء.
– يساعد على استخراج الطاقة من الطعام، وينتج مواد مشابهة للهرمونات تساعد على تنظيم ضغط الدم ونبضات القلب وعلى سرعة التئام الجروح.
– كما يساعد الجسم في مقاومة الأمراض المزمنة كالسرطان وأمراض الشيخوخة.
– عنصر ضروري يدخل في تكوين المفاصل والأعصاب وهو المسؤول عن حاسة التذوق.
– من المعروف أن الخلايا البيضاء تقاوم العدوى وبذلك إن نقص النحاس يعطل الخلايا البالغة في مقاومتها للمرض.
المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- العناصر الانتقالية – كتاب الصف الثالث الثانوي – جمهورية مصر العربية 2021