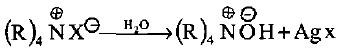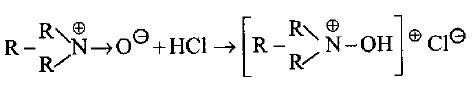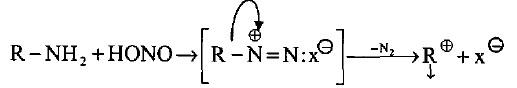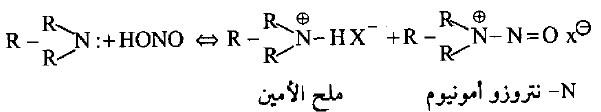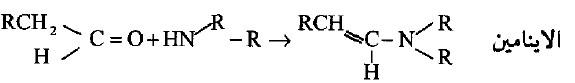تفاعلات الأمينات Reaction of Amines
تفاعلات الأمينات Reaction of Amines
– فيما يلي أهم تفاعلات الأمينات:
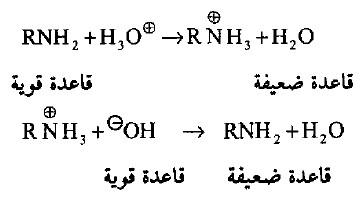
(1) قاعدية الأمينات (التفاعل مع الأحماض)
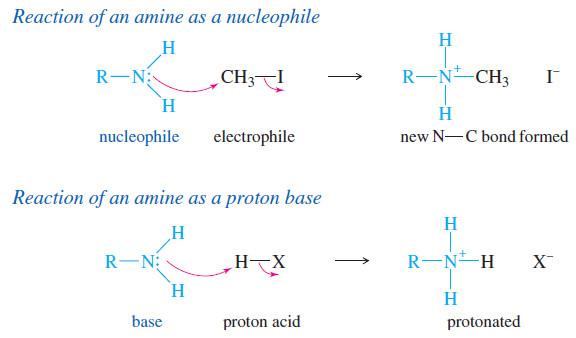
– تتحول الأمينات (وكما في الأمونيا) إلى الأملاح المقابلة عند تفاعلها مع الأحماض المعدنية. وتتحرر من أملاحها بإضافة قاعدة قوية لذلك فأن الأمينات تعتبر قواعد أقوى من الماء وأضعف من الهيدروكسيد.
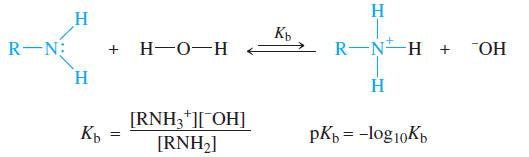
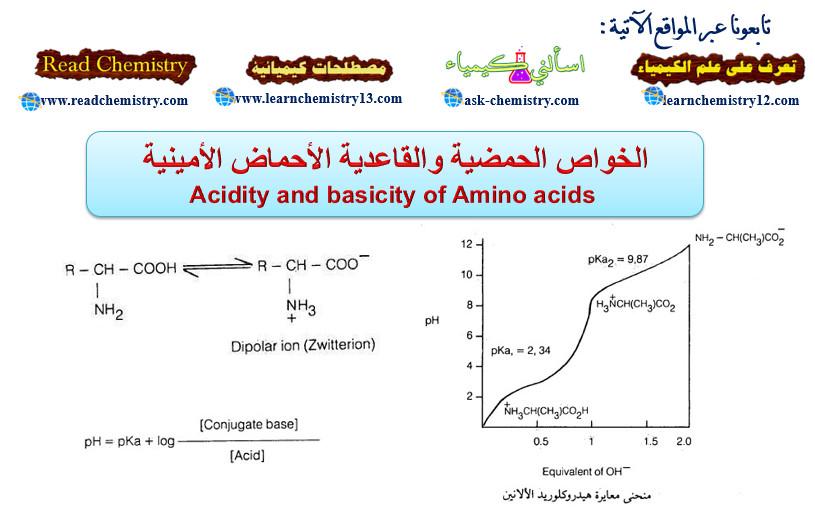
– قوة القاعدية تقاس بمدى قبول الأمين للبروتون من الماء في تفاعل متوازن مع الماء نتمكن من خلاله معرفة ثابت القاعدية Kb.
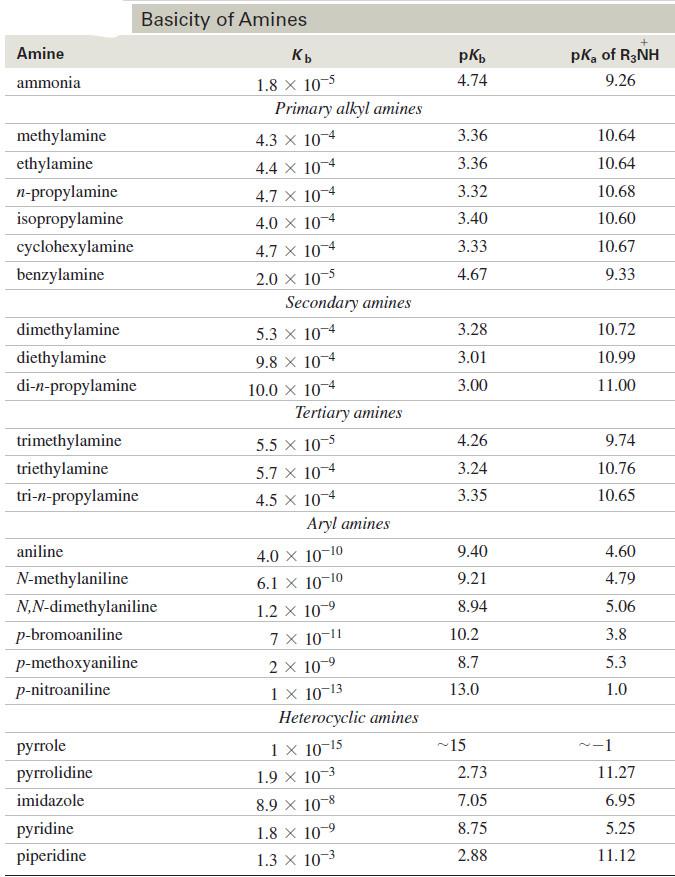
– كلما ازداد ثابت القاعدية زادت قاعدية الأمين.
– من ملاحظة الجدول أدناه يمكن القول بأن الأمينات الأليفاتية بأصنافها الثلاث أقوى قاعدية من الأمونيا. بينما تكون الأمينات الأروماتية وفي مقدمتها الأنيلين قواعد ضعيفة جداً قياساً إلى الأمونيا.
– الجدول أعلاه يبين تأثير المجاميع الموجودة في حلقة الأنيلين على قوة القاعدية فالمجاميع الساحبة للإلكترونات مثل النترو والسلفون والكربوكسيل تقلل من قاعدية الأنيلين لأنها تقلل من احتمال وجود الزوج الإلكتروني على ذرة النتروجين بينما تعمل المجاميع الدافعة للالكترونات مثل الأمينو والميثوكسي والألكيل على زيادة قاعدية الأنيلين من خلال زيادة الكثافة الإلكترونية وزيادة احتمال وجود الزوج الإلكتروني على ذرة النتروجين.
(2) تفاعل الألكلة (حذف هوفمن) Hofmann elimination
– للأمينات (والأمونيا) قابلية على التفاعل مع هاليدات الألكيل لإعطاء أمين من صنف أعلى في تفاعل استبدالي نيوكليو فيلي يتم فيه استبدال ذرة هيدروجين مجموعة الكيل (تفاعل ألكلة).
– ولما كانت الأمينات الثانوية والثالثية هو نواتج جانبية لتحضير الأمينات الأولية بالطريقة المذكورة فمن المؤكد أن الناتج النهائي سيكون الملح الرباعي للأمين –R4N+X والذي يكون متوازن كهربائياً ولا يتأثر بالقاعدة لعدم وجود ذرة هيدروجين.
– يمكن تحويل هذا الملح الرباعي إلى هيدروكسيد الأمونيوم الرباعي بمفاعلته مع أكسيد الفضة.
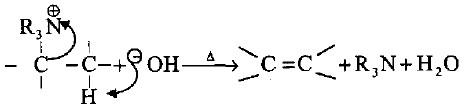
– يتحلل الهيدروكسيد الناتج عند حرارة 125oم فما فوق ليعطي الماء والأمين الثالثي والألكين المقابل في تفاعل يدعى (تفاعل هوفمن الحـذفي Hofmann Elimination) والمشابه لحذف جزيئة HX من هاليد الألكيل.
– غالباً ما تكون ميكانيكية التفاعل هو سحب بروتون بواسطة الرابطة المزدوجة من خلال حذف المجاميع من مواقع متقابلة (Anti) لتأمين المتطلبات الفراغية للرابطة المزدوجة.
– يمكن القول بأن التكوين المتقابل (Anti) للرابطة المزدوجة هو أكثر احتمالاً في الحذف.
– إن تكوين ملح الأمونيوم الرباعي ومن ثم تفاعل الحذف هو من التفاعلات التشخيصية المهمة في معرفة تراكيب بعض الأمينات المجهولة والمعقدة والتي قد تكون من إحدى أصناف الأمين الثلاثة والتي تتحول إلى الهيدروكسيد الرباعي عنـد معاملتها مع كمية وافرة من يوديد المثيل وأكسيد الفضة:
- الأمين الأولي يضيف ثلاثة مجاميع مثيل.
- الأمين الثانوي يضيف مجموعتي مثيل.
- الأمين الثالثي يضيف مجموعة مثيل واحدة.
– هذا التفاعل يدعى الكلة الأمين القصوى Exhaustive methylation of Amines
(3) تحويل الأمينات إلى الأميدات Amide formation
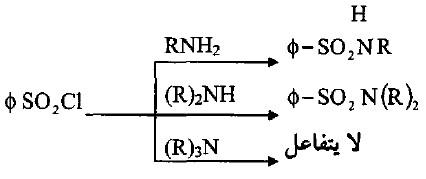
– تدخل الأمونيا والأمينات الأولية والثانوية مع كلوريد الحمض وكلوريد حمض السلفونيل في تفاعل استبدال نيوكليوفيلي حيث تهاجم الأمينات (الزوج الالكتروني غير المرتبط على ذرة النتروجين) ذرة الكربون في كلوريد الحمض أو ذرة الكبريت في كلوريد السلفونيل مع مغادرة ذرة الكلور وفقدان بروتون من قبل النتروجين إلى جزيئة أمين أخرى أو إلى قاعدة أخرى.
– تتكون الأميدات الأكسجينية أو الأميدات السلفونية في حالة تفاعل الأمونيا أو الأمينات عدا الثالثية التي تفشل في هذا التفاعل لعدم وجود ذرة هيدروجين قابلة للاستبدال وبذلك يكون تفاعل كلوريد السلفونيل مع الأمينات المختلفة تفاعلاً تشخيصياً لصنف الأمين (كشف هينزبرك Hinsberg test).
– حيث تتفاعل الأمينات الأولية والثانوية مع كلوريد السلفونيل لاحتوائها على ذرة نتروجين قابلة للاستبدال. بينما لا تحتوي الأمينات الثالثية على ذرة هيدروجين وبذلك يمكن التمييز بينها وبين بقية الأمينات.
– إن التحلل المائي للأميدات المعوضة والأميدات البسيطة يعطي الأمينات الأصلية وأملاح الأحماض في الوسط القاعدي أو ملح الأمين والحمض الأصلي في الوسط الحمضي.
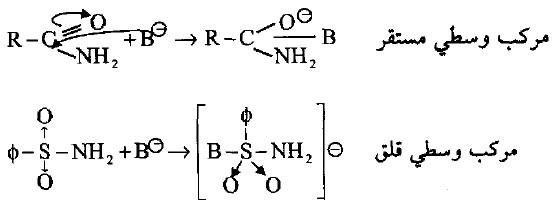
– أما أميدات السلفون فأنها تتحلل مائياً وبصورة أبطأ من أميدات الأحماض الكربوكسيلية ويعود ذلك إلى الشكل الفراغي للأميد المتكون، فالأميد للحمض الكربوكسيلي (ذو الشكل الهرمي الثلاثي) سوف تتم مهاجمته من قبل القاعدة (–B) والتي سوف لن تلاقي إعاقة فراغية مثل الإعاقة التي تواجهها من قبل جزيئة أميد السلفون (ذات الشكل الهرمي الرباعي) لذلك فأن التحلل المائي لأميد الحمضي الكربوكسيلي سيكون أسهل من التحلل المائي لأميد السلفون.
– توضح المركبات الوسطية أعلاه أن ذرة الكربون في الحالة الأولى تتحول إلى الشكل الهرمي الرباعي المستقر أما في الحالة الثانية فأن ذرة الكبريت المرتبطة بخمس ذرات أو مجاميع يحتوي مدارها الخارجي على عشرة إلكترونات مما يجعل الحالة الوسطية قلقة أو صعبة التكوين، لذا ومن الناحية الفراغية والإلكترونية فأن أميدات السلفون تكون أقل فعالية من أميدات الحامض الكربوكسيلي.
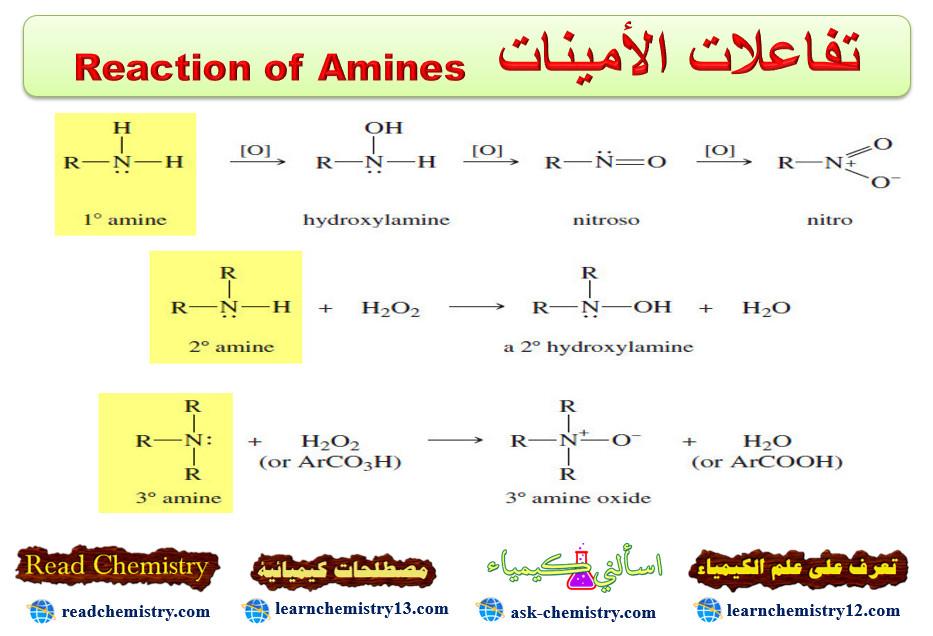
(4) الأكسدة Oxidation
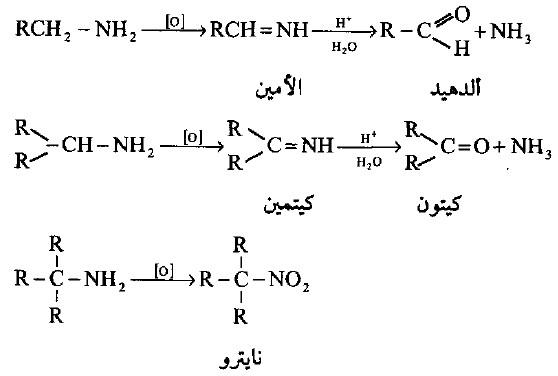
– تقاوم الأمينات الأليفاتية تفاعلات الأكسدة في محاليلها الحامضية نتيجة لتكون أملاحها بينما تتأكسد الأمينات الأولية بسهولة حيث تعطي نواتج مختلفة باختلاف العامل المؤكسد ومجاميع الألكيل المرتبطة بها.
(أ) الأكسدة بواسطة برمنجنات البوتاسيوم
– تتأكسد الأمينات الأولية إلى مركبات الكربونيل وتعتمد نواتج التفاعل على المجاميع الألكيلية المرتبطة بذرة الكربون الفا المجاورة لمجموعة الأمين.
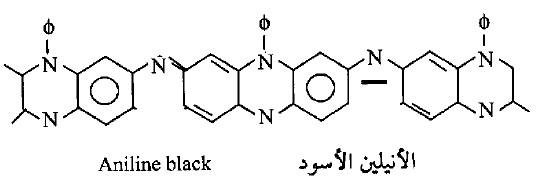
– أما الأمينات الأروماتية فأنها تتأكسد بسهولة ويتبدل لونها ويصبح غامقاً عند تعرضها للهواء ومع العوامل المؤكسدة القوية فأن الأنيلين يتحول إلى مركب معقد من المحتمل أن يكون له التركيب التالي:
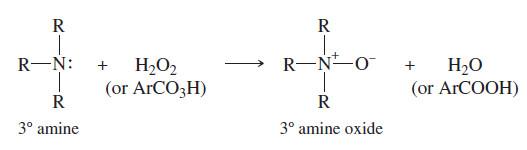
(ب) الأكسدة بواسطة بيروكسيد الهيدروجين H2O2
– تتأكسد الأمينات الأليفاتية الثالثية والأروماتية بواسطة بيروكسيد الهيدروجين لاعطاء مشتقات N- أكسيد.
– طبيعة التفاعل تتضمن تكوين رابطة N-O تكون مستقطبة نحو الاكسجين الأكثر سالبية (رابطة موهوبة / تناسقية) أي أن الزوج الالكتروني لذرة النتروجين يوهب إلى الأكسجين لإكمال غلافه الخارجي وأن المشاركة في صنع هذه الرابطة هي من ذرة النتروجين فقط وليست مشاركة متساوية بين الذرتين.
– تكون هذه الرابطة قطبية قوية حيث تبين من خلال قياسات عزم ثنائي القطب أنها تظهر تجاذب كهربائي قوي لأن طول الرابطة -N سيكون Ao1.36 فقط.
– كما أن الكثافة الالكترونية العالية على ذرة الأكسجين ستظهر الصفات القاعدية الضعيفة لمركبات – أكسيد والتي تذوب بسرعة في حمض الهيدروكلوريك المخفف مكونة الأملاح.
– نتيجة للشد القطبي الكبير في الجزيئة فأن درجة غليان هذه المركبات سيزداد بشكل ملحوظ وهذا ما نلاحظه في ثلاثي مثيل الأمين الذي يغلي في درجة 3.5°م بينما لا يغلي أكسيده في أقل من 180oم مع التفكك.
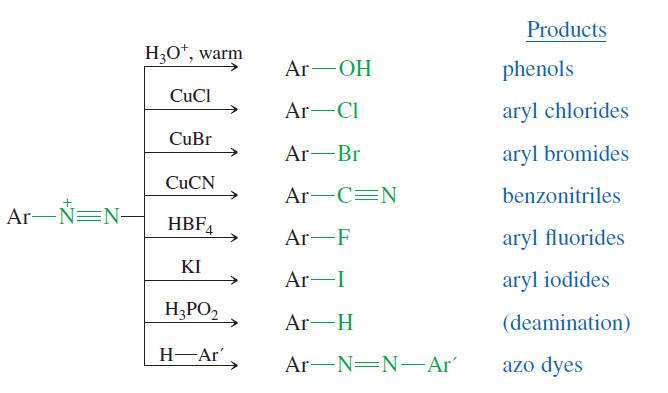
(5) تكوين أملاح الديزونيوم Diazonium Salts
– تتفاعل جميع أصناف الأمينات مع حمض النتروز HNO2 لإعطاء أملاح ديزونيوم قلقة وغير مستقرة.
– حيث تتفكك حتى في درجات الحرارة المنخفضة وتحرر غاز النتروجين مع تكوين كاربوكتيونات فعالة لها القدرة على الدخول في تفاعلات مهمة عديدة.
– وفي نفس الوقت قد يدخل الكربوكاتيون المتكون في تفاعلات داخلية قد تفقده الفعالية.
– حمض النتروز حمض ضعيف غير مستقر يتكون في المحلول من تفاعل نتريت الصوديوم مع أحد الأحماض القوية مثل HCl أو H2SO4.
(أ) مع الأمينات الأولية
– تدخل الأمينات الأولية في تفاعل ديازة (diazotization) وفق الميكانيكية التالية:
كحولات وهاليدات الكيل والكينات
– نظراً إلى أن الناتج سيكون خليطاً من الكحولات والألكينات والهاليدات والتي تتقارب في درجات غليانها لذلك فأن التفاعل ليست له أهمية على المستوى التحضيري لكن يمكن الاستفادة منه في تحديد عدد مجاميع الأمين الأولية في أي مركب مجهول من خلال قياس حجم النتروجين المتحرر أثناء التفاعل.
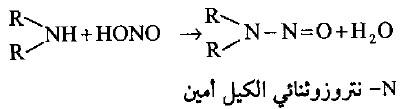
(ب) مع الأمينات الثانوية
– يضاف حمض النتروز إلى الأمينات الثانوية لإعطاء مركبات N- نتروزو الأمين. والتي غالباً ما تكون سوائل زيتية ذات درجات غليان عالية.
– كما أن لها فعالية بيولوجية مع الخلايا الحية تؤدي إلى الإصابة بالسرطان الأمر الذي أدى إلى منع استخدام مكوناتها الأصلية (نتريت الصوديوم) في حفظ الأطعمة والمعلبات تحاشياً لتفاعله مع الأحماض الأمينية الموجودة في الجسم الحي وتكوين هذه المركبات.
– كما توجد مركبات النتروزو في التبغ المحروق والسكائر.
(جـ) مع الأميدات الثالثية
– تذوب الأمينات الثالثية في محلول حمض النتروز مكونة أملاح تحتوي على مجموعة النتروزو -NO. وبعضها يكون على شكل معقد كما يحدث اتزان كيميائي للتفاعل بين المركبات المتفاعلة والمركبات الناتجة.
– كما يؤدي تفكك النواتج في درجة حرارة 50oم في المحلول الحامضي إلى تكوين الألدهيدات والكيتونات وبكميات ضئيلة لا تصلح تجارياً.
– الشكل التالي يوضح تفاعل املاح الديازنيوم الاروماتية للحصول على مجموعات وظيفية أخرى كما يلي:
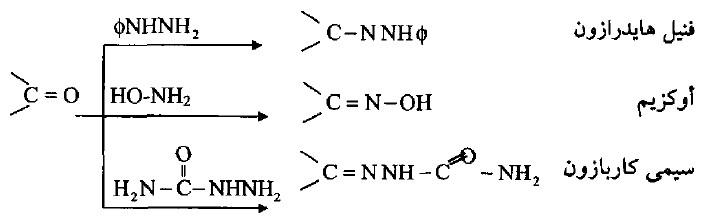
(6) التفاعل مع مركبات الكربونيل
– تضاف الأمينات الأولية ومشتقاتها الهيدرازينات والهيدروكسيل أمين والسيمي كاربازيد إلى مركبات الكربونيل في تفاعلات تحضيرية وتشخيصية.
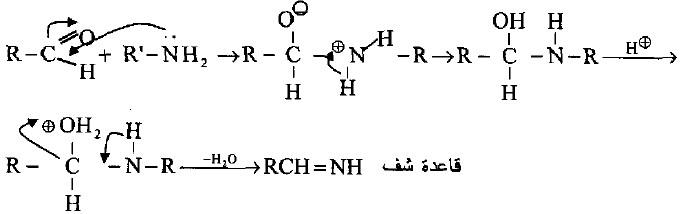
(أ) مع الألدهيدات (تكوين قواعد شف)
– تتفاعل الأمينات الأولية مع الألدهيدات (سيما الأروماتية) لتكوين مركبات نتروجينية غير مشبعة (الأنيلات (Anils) تدعى قواعد شف Schiff’s bases
>- حيث يتم التفاعل بالإضافة النيوكليوفيلية لمجموعة الأمين إلى ذرة كربون مجموعة الكربونيل للألدهيد يتبعها انتقال بروتون من ذرة النتروجين الموجبة إلى ذرة الأكسجين السالبة عبر تكوين حالة وسطية تحتوي على مجموعة هيدروكسيل التي تتحول إلى آيون هيدرونيوم ويفقد ماء لتكوين الناتج النهائي.
(ب) مشتقات الأمونيا مع مركبات الكربونيل (الألدهيدات والكيتونات)
– تشمل هذه التفاعلات مشتقات الأمونيا (الأمينات الأولية).
– أما الأمينات الثانوية فأنها تتفاعل مع مركبات الكربونيكل (الدهيدات وكيتونات) لتكوين الإينامينات (Enamine).
المراجع
- الكيمياء العضوية الإليفاتية – د/ عادل شاكر الطائي – دار المسيرة للنشر والتوزيع – عمان – الأردن – 2009
- Organic chemistry / L.G. Wade, Jr / 8th ed, 2013 / Pearson Education, Inc. USA
- Unergraduate Organic Chemistry /Dr. Jagdamba Singh, Dr. L.D.S Yadav / 1st ed, 2010/ Pragati prakashan Educational Publishers, India.
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States