النيتروبنزين Nitrobenzene – تجربة تحضير النيتروبنزين
محتويات الموضوع
تجربة تحضير النيتروبنزين فى المعمل Preparation of Nitrobenzene
– يتم تحضير النيتروبنزين فى المعمل بواسطة نيترة الهيدروكربونات الآروماتية Nitration of Aromatic Hydrocarbons
أولاً/ الجزء النظري لتجربة تحضير النيتروبنزين
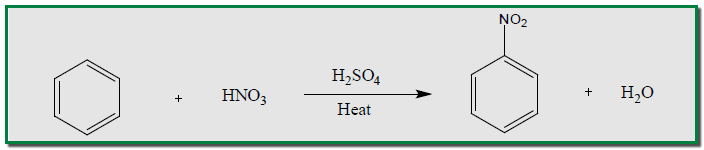
– يحضر النيتروبنزين من تفاعل حمض النيتريك المركز مع البنزين بوجود حمض الكبريتيك المركز كعامل مساعد إذ يرتبط نتروجين مجموعة النترو بكربون الحلقة الآروماتية.
– معادلة تفاعل البنزين مع حمض الكبريتيك لتحضير النيتروبنزين كما يلي:
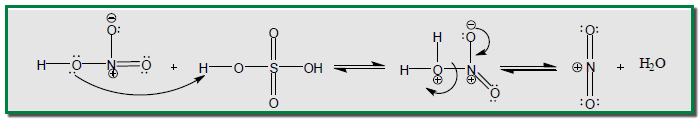
– يعمل حمض الكبريتيك على تجهيز وسط حامضي وتحويل حمض النيتريك إلى النترونيوم +NO2 شديد الفعالية والذي يكون هو العامل الحقيقي في النيترة.
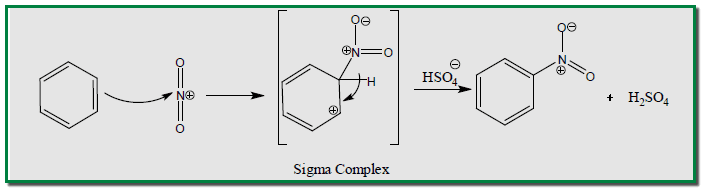
– إن ميكانيكية الإحلال في الحلقة الآروماتية تشمل هجوم الكاشف الالكتروفيلي )ايون النترونيوم( على الحلقة الآروماتية والتي تعد كاشفا نيوكليوفيلياً ، لتعطي أيون الكربونيوم حيث ينتقل منه بروتون إلى أيون البيكبريتات التي تكون هي المادة الأقوى قاعدية في مزيج التفاعل.
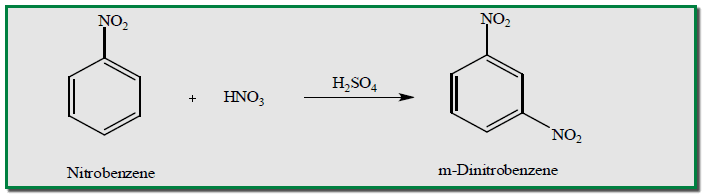
– إن المواد التي لا يحدث فيها نيترة بسهولة بمزيج حمضي النيتريك وحمض الكبريتيك المركزين يمكن أن تزداد شدة التفاعل باستعمال حمض الكبريتيك الداخن) المحتوي على أكثر من 60% من ثالث أكسيد الكبريت (أو بحمض النيتريك الداخن.
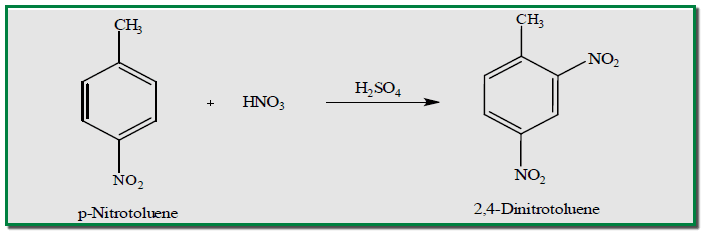
– لذلك يتحول النيتروبنزين بواسطة مزيج من حمض النيتريك الداخن وحامض الكبريتيك المركز إلى ) الميتا داي نتروبنزين(m-Dinitrobenzene بمنتوج حوالى 90% مع كميات قليلة من ايزومرات الاورثو والبارا، والأخير يمكن التخلص منه وحذفه بإعادة بلورة المنتوج في مذيب مناسب.
كذلك يمكن تحويل البارا – نتروتولوين إلى 2.4 – داي نتروتولوين كما يلي :
– إن مجموعة النترو هي مجموعة غير مشبعة وتحتوي ذرة النتروجين شحنة موجبة، بينما تكون مجموعة الهيدروكسيل مشبعة.
– فمجموعة النترو الموجهة نحو الميتا تجعل التعويض أكثر صعوبة أي تقلل من نشاط الحلقة الآروماتية.
– أما مجموعة الهيدروكسيل الموجهة نحو مواقع الاورثو والبارا تسهل التعويض وتؤدي إلى تنشيط الحلقة الآروماتية.
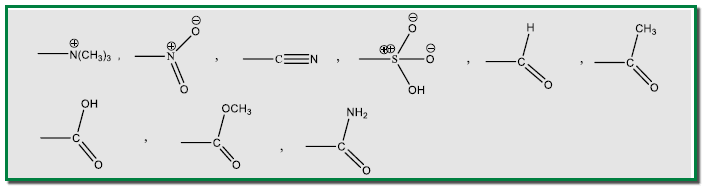
المجاميع الموجهة نحو الميتا
– تشمل تلك المجاميع التي تكون فيها الذرة المرتبطة بالحلقة الآروماتية مباشرة موجبة الشحنة أو غير مشبعة تماماً وهي كما يلي:
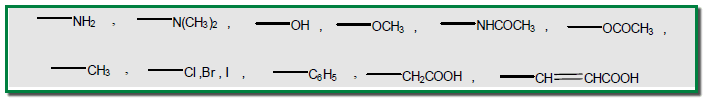
المجاميع الموجهة نحو الاورثو والبارا
– وتشمل تلك المجاميع المشبعة أو التي تكون غير مشبعة نوعا ما في المنطقة التي ترتبط بالحلقة وهي كما يلي:
ثانياً/ الجزء العملي لتجربة تحضير النيتروبنزين
الأدوات والمواد الكيميائية المطلوبة
الأجهزة والأدوات
– يتم توفير الأدوات الآتية كما يلي:
- دورق دائري 250 ml
- مكثف عاكس
- محرار (ميزان حرارة أو ترمومتر)
- قمع فصل
- حمام مائي
- دورق مخروطي
- بيكر
المواد الكيميائية المطلوبة
– يتم توفير المواد الكيميائية الآتية كما يلي:
- بنزين
- حمض النيتريك المركز
- حمض الكبريتيك المركز
- بيكربونات الصوديوم
- كلوريد الكالسيوم اللامائي.
خطوات التجربة
(1)ضع 21 ml حامض النيتريك المركز في دورق دائري سعة 250 ml ، وأضف بعده دفعات مع التحريك 25 ml من حامض الكبريتيك المركز.
(2)دع المزيج يبرد خلال الدفعات بغمر الدورق في الماء البارد ، ضع ترمومتر في مزيج الحامض.
(3) أضف 17.5 ml من البنزين بدفعات (3-2) ml لكل دفعة ، رج محتويات الدورق جيدا لمزجها تماماً بعد كل إضافة من البنزين، لا تدع درجة حرارة المزيج تصل فوق) 55 Co اغمر الدورق عند الضرورة في الماء البارد(.
(4) بعد إتمام إضافة البنزين رتب مكثفاً عاكساَ إلى الدورق وسخن حمام مائي درجة حرارته) 60 Co لا تدع درجة الحرارة ترتفع أكثر( لمدة (45-40) min أرفع الدورق بين فترة وأخرى من الحمام المائي ورجه بشدة.
(5) أضف خليط التفاعل إلى 150 ml من الماء البارد في بيكر ، حرك المزيج لغسل النيتروبنزين ، ثم أترك المزيج ليركد )ناقش؟(
(6) اسحب طبقة المائية العلوية وانقل السائل المتبقي إلى قمع فصل ثم استقبل الطبقة السفلية للنتروبنزين وأهمل الطبقة العلوية المائية.
(7) أضف ماء جديد إلى النيتروبنزين في قمع الفصل لغسله مرة أخرى وحرك الخليط ، كرر الغسيل مرتين ، ارمي طبقة الماء العلوية.
(8) أعد النيتروبنزين إلى قمع الفصل ورجه بشدة مع حوالي 50 ml من محلول بيكربونات الصوديوم المخفف للتفاعل مع الحوامض الزائدة.
(9) نسحب طبقة النيتروبنزين إلى دورق مخروطي وجفف باستخدام كلوريد الكالسيوم اللامائي CaCl2 ، رشح النيتروبنزين وقطر بجهاز تقطير البخاري ، ثم اجمع الجزء المتقطر عند درجة (211 – 206) Co
ملاحظات هامة
– النيتروبنزين ) وكثير من المركبات العضوية السائلة المحتوية على النتروجين (هو سام نوعا ماً وأبخرته يجب أن لا يسمح لها بالانتشار في جو المختبر ، فيجب أن تغمر نهاية المكثف جيداً في دورق الاستلام.
– النيتروبنزين أيضاً سام عن طريق الجلد وعند سقوطه على الجلد يجب إزالته بالغسل بكمية قليلة من الكحول الميثيلي ثم بالصابون والماء الساخن.
تعليمات السلامة داخل المختبر الكيميائي
يجب عليك قبل بدء التجربة مراعاة التعلميات الآتية كما يلي:
(1) يجب مراعاة نظافة المختبر والأدوات المستخدمة به.
(2) يجب عدم إلقاء المواد الكيماوية بالأحواض إلا بعد تخفيفها. ولا يجوز نهائيا إلقاء قطع أو قشور الصوديوم في الأحواض.
(3) كما يجب أن تكون الأرضيات وكذلك أسطح الطاولات من مواد مقاومة للحريق والمواد الكيماوية وسهلة التنظيف.
(4) يجب غسل الأواني التي بها بقايا مواد سريعة الاشتعال بعد انتهاء العمل بها.
(5) يجب عدم تخزين الكيماويات أو عينات المواد المراد حفظها داخل المختبر إلا بأقل قدر ممكن ولحاجة العمل فقط.
(6) كما يجب عدم حفظ السوائل السريعة التبخر إلا في الثلاجات. ويجب الانتباه عند تغطية زجاجات الكيماويات.
(7) يجب وضع إناء مملوء بالرمل تحت القناني التي لا يوجد سبيل آخر لحمايتها. واعلم أن استخدام الرمال والتراب لامتصاص الأحماض المنسكبة على الأرض من الوسائل الآمنة من وجهة نظر السلام.
(8) عند تسخين مواد سريعة الاشتعال يجب استخدام حمام مائي.
(9) لا تحاول أن تدخل بقوة أنبوبة في سدادة فلين أو مطاط. بلل الزجاج بالماء أو الزيت أولاً لان ذلك يسهل ألي حد كبير هذه العملية.
أحتياطات أخرى
(10) يجب تداول المواد الخطرة حسب الأسس العلمية. وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه.
(11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر. ومراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائياً حيث إنها تشتعل بمجرد تعرضها للهواء.
(12) كما يجب أن يكون بكل مختبر أكثر من مخرج. ويفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج.
(13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يومياً ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة.
(14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه.
(15) كما يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر.
(16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وأن تكون مزودة بمروحة سحب مناسب.
المراجع: تجارب فى الكيمياء العضوية. أسعد هاشم عنيد – حيدر مصطفي كمال – نهي سلمان صالح – أحمد حسون مجيد ، الطبعة لأولى (2015م) / جامعة الكوفة – كلية العلوم – العراق







لماذا حرارة الحمام المائي لا يتجاوز ٦٠درجة مئوية عند نيترة المباشرة لحلقة البنزين
سوف يصبح ميتا داي نترو بنزين بدلاً من نترو بنزين
لماذا الغسيل المائى ؟