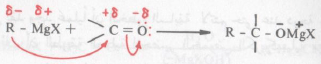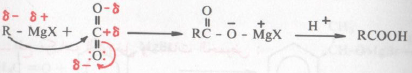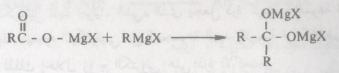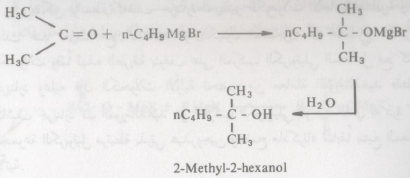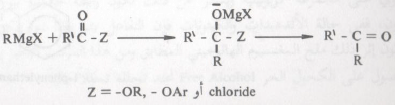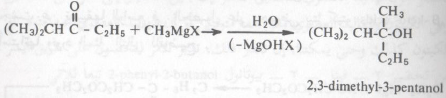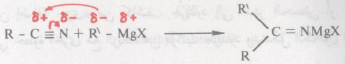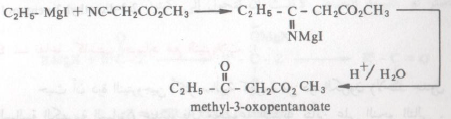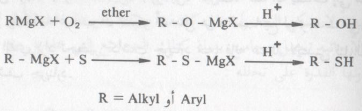تفاعلات كواشف جرينارد Grignard Reagents Reactions
ما هي كواشف جرينارد Grignard Reagents
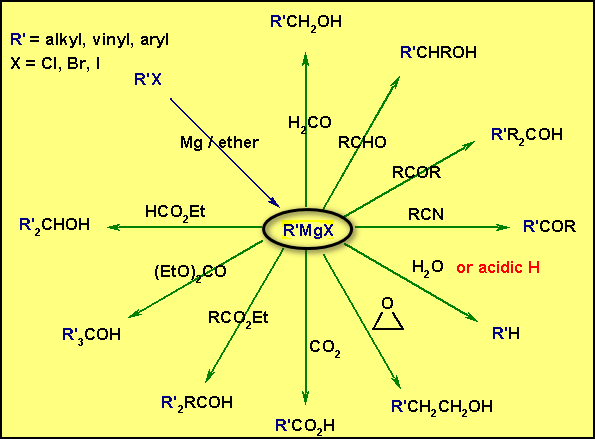
–الصيغة العامة لمركب جرينارد (كواشف جرينارد) هي (RMgX) حيث ترمز (X) للهالوجين وأما (R) فقد تكون مجموعة ألكيلية (سلسلة كربونية مفتوحة مشبعة أو غير مشبعة). أو قد تكون مجموعة أريلية Aryl group.
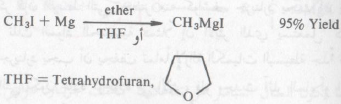
– يحضر كاشف جرينارد من تفاعل الهاليد العضوي مع حبيبات الماغنسيوم في وجود الأيثر الجاف. وتختلف الهاليدات العضوية اختلافاً بيناً في سرعة اتحادها مع المغنسيوم ـ فقد تتفاعل هاليدات الألكيل مع الماغنسيوم في الأيثر الجاف بسرعة أكبر من تفاعل الهاليدات الأروماتية.
وقد يكون التفاعل عنيفاً في بدايته ولذا فإنه يلزم التبريد من آن إلى آخر أثناء فترة التحضير حتى يمكن الحفاظ على الكمية اللازمة من الايثر (يغلي عند درجة ٣٥°م). وباستمرار التفاعل يختفي معدن الماغنسيوم ويعرف حينئذ المحلول الناتج بكاشف جرينارد. وفعالية هذا الكاشف RMgX تنشأ الفرق الكبير في السالبية الكهربية للماغنسيوم بمقارنته بذرة الكربون الرابطة معه (Rδ- : Mgδ+ – X )
تفاعلات كواشف جرينارد Grignard reagents Reactions
أولاً/ تفاعل كواشف جرينارد مع المركبات المحتوية على هيدروجين نشط Active Hydrogen Compounds
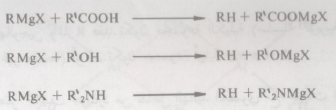
– تتفاعل الحموض الكربوكسيلية، الماء، الكحولات، الفينولات، الأمونيا، الأمينات الأحادية والثنائية، تتفاعل كل هذه المواد (كحموض) مع كواشف جرينارد.
– ويسفر هذا التفاعل عن تكوين الهيدروكربون المشتق من المجموعة الألكيلية أو الأريلية لكاشف جرينارد المستعمل بالإضافة إلى تكوين ملح الماغنسيوم الهالوجيني Halomagnesium Salt للمادة الحمضية المتفاعلة مع مرکب جرينارد.
R: قد تكون مجموعة الكيلية أو أريلية .
`R: قد تكون مجموعة الكيلية أو أربلية أيضاً.
– وحيث أن مركب جرينارد شديد الفعالية مع المواد ذات الصفة الحمضية الآنفة الذكر فإن الوسط التي تحضر منه كواشف جرينارد يجب أن يكون خالياً من تماماً تلك المواد الحمضية.
– فمثلاً إن الايثر الذي يستعمل كمذيب في تفاعلات جرينارد يجب أن يجفف تماماً لإزالة الكميات البسيطة جداً من الماء أو الكحول. والتي تكون عادة موجودة في الايثر، فلو وجدت آثار الماء أو الكحول في الايثر فإن هذا يعيق تكون كاشف جرينارد.
– أن تكوين كاشف جرينارد يوصف بأنه محفز ذاتي Autocatalytic أي عندما تتكون الكمية البسيطة منه فهي تعمل حفزياً لتكوين كمية أكثر وأكثر ففي حالة وجود الماء في المحلول فهو يتفاعل مع الكمية البسيطة من الكاشف المتكون في بادئ الأمر، مما يؤدي إلى إزالته من المحلول وبهذا يتوقف العمل الحفزي لتكوين كمية أخرى منه.
– قد يكون التحلل المائي لكاشف جرينارد في كثير من الأحيان ذا منفعة خاصة كوسيلة لاختزال الهاليدات العضوية كما يتضح من المثال التالي:
ثانياً/ تفاعل كواشف جرينارد مع ثاني أكسيد الكربون
– إن الطبيعة النيكلوفيلية لمجموعة الألكيل أو الأريل في كاشف جرينارد هي المسئولة عن أهم وأغلب تفاعلات هذه الكواشف.
– فالهجوم النيكلوفيلي من هذه المجموعة على ذرة الكربون القابلة لذلك (التي تحمل جزئياً شحنة موجبة)، يسفر عن تكوين رابطة جديدة بين ذرتي كربون C – C.
– تتأين الرابطة المضاعفة لمجموعة الكربونيل تأيناً جزئياً، الشيء الذي يجعل ذرة كربون مجموعة الكربونيل مجموعة قابلة للهجوم النيكلوفيلي من المجموعة الهيدروكربونية في كاشف جرينارد ويتم نتيجة لذلك إحلال زوج الكتروني على ذرة الأكسجين.
– وربما يكون المثال المباشر من تفاعلات كاشف جرينارد «والتي ينشأ فيها تكوين رابطة بين ذرتي كربون» هو تفاعله مع ثاني أكسيد الكربون. فذرة كربون أكسيد الكربون مشحونة شحنة إيجابية جزئية بسبب السالبية الكهربية لذرات الأكسجين وعلى هذا فإن الهجوم النيكلوفيلي على ذرة الكربون يسفر عن إستبدال زوج الكتروني على ذرة أكسجين جزئ ثاني أكسيد ويتشكل عندئذ أيون الكربوكسيليت carboxylate ion ومن ثم الحصول على الحمض الحر Free acid بواسطة الحموض المعدنية.
الحمض الكربوكسيلي – قد يكون أليفاتي أو أروماتي
ولقد يخطر بالبال أن ملح الحمض المتكون ـ السابق ـ قد يتفاعل في خطوة أخرى مع الكاشف وذلك لاحتوائه على مجموعة كربونيلية في حد ذاته.
ولكن لقد وجد عملياً أن الخطوة السابقة لا تتم حتى عند درجة حرارة الغرفة فضلاً عن ذلك أن الطريقة العملية لتحضير الحموض الكربوكسيلية من كواشف جرينارد تتم عند درجات حرارة منخفضة وذلك بإضافة محلول كاشف جرينارد إلى ثاني أكسيد الكربون الصلب والمسحوق جيداً Dry Ice.
عموماً فإن تفاعل كواشف جرينارد مع ثاني أكسيد الكربون هي طريقة عامة للحصول على الحموض الكربوكسيلية سواء أليفاتية أو أرومانية،
– فعندما يتهيأ لنا الحصول على الهاليد العضوي المناسب (يجب أن يكون جزئ الهاليد العضوي لا يحتوي على مجموعة فعالة تتفاعل مع كاشف جرينارد)، تأتى عندئذ تحضير كاشف جرينارد ثم الحصول على الحمض الكربوكسيلي المطابق والذي يزيد ذرة كربون واحدة من عدد ذرات كربون المجموعة الهيدروكربونية للهاليد العضوي المستعمل.
ثالثاً/ تفاعل كواشف جرينارد مع مركبات الكربونيل ومشتقات الحموض
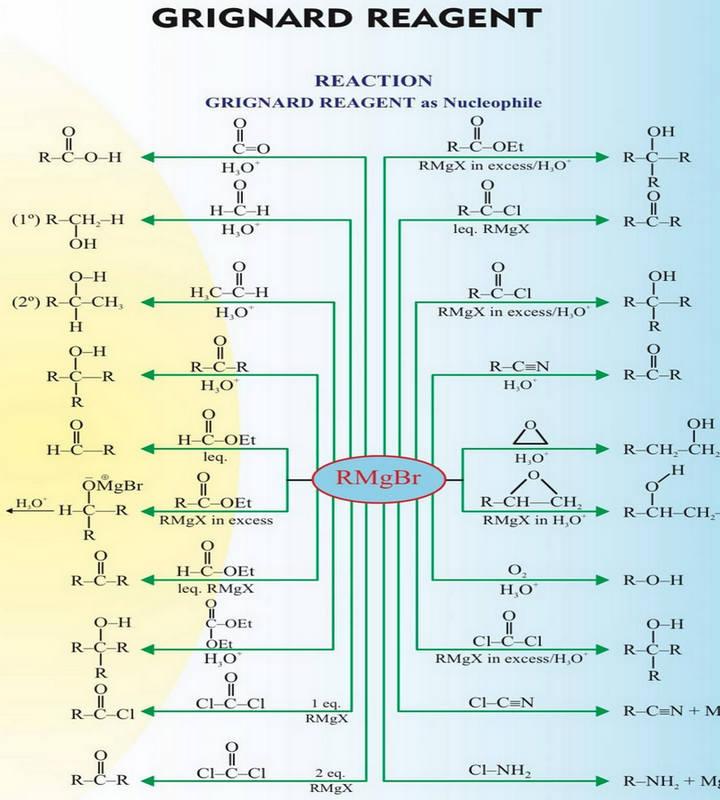
– لقد رأينا قبل قليل أن مركب جرينارد يمكنه أن يتفاعل مع أي مركب يحتوي على مجموعة كربونيلية ويسفر عن ذلك تكون رابطة جديدة بين ذرتي كربون.
(أ) في حالة التفاعل مع الألدهيدات والكيتونات
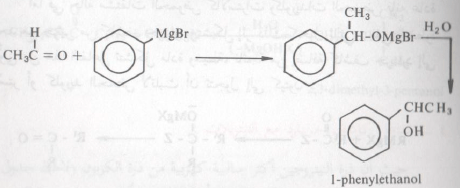
– ففي حالة الألدهيدات والكيتونات فإن التفاعل يتم وفقاً لما ذكر آنفا ويتكون إثر ذلك ملح المغنسيوم الهالوجيني المطابق ومن هذا المركب الأخير يمكن الحصول على الكحول الحر Free Alcohol عند تحلله تحللاً مائياً.
– يمكن بواسطة كاشف جرينارد تحضير الكحولات الأحادية والثانوية والثالثية وذلك عند تفاعله الألدهيد أو الكيتون المطابق.
– أن اصطناع الكثير من الكحولات وفقاً لهذه الطريقة يتوقف على المركب الكربونيلي المتفاعل مع كاشف جرينارد. وعليه فإن الكحولات الأولية تحضر من معاملة الفورمالدهيد فقط مع كاشف جرينارد لأن الفورمالدهيد هو المركب الكربونيلي الوحيد الذي به ذرة كربون مجموعة الكربونيل مرتبطة بذرتي هيدروجين ويتضح ما ذكرناه سابقاً بتتبع المعادلات الآتية:
– أما الكحولات الثانوية والثالثية فتحضر من تفاعل جرينارد مع الألدهيدات والكيتونات على التوالي كما يتضح من الأمثلة التالية:
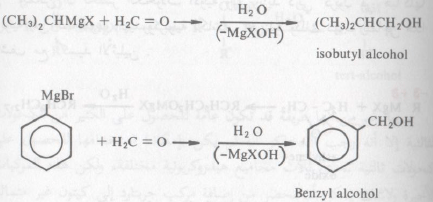
– ويمكن أن تحضر الكحولات الأولية والتي تزيد ذرتي كربون في هياكلها الكربونية عن المجموعة الهيدروكربونية لكاشف جرينارد وذلك نتيجة لتفاعل هذا الكاشف مع أكسيد الأثيلين .

R = مجموعة أليفاتية أو أروماتية
– نظراً لتوتر الحلقة الثلاثية في أكسيد الاثيلين فإنه يتفاعل مع كاشف جرينارد وذلك بكسر رابطة سيجما بين ذرتي الكربون والأكسجين.
(ب) في حالة التفاعل مع مشتقات الأحماض
– أما في حالة مشتقات الحموض كالاسترات وكلوريدات الحموض فإنه عادة تتحد مع جزئيين من كاشف جرينارد ويتشكل إثر ذلك كحول ثالثي .
– ففي الخطوة الأولى من هذا التفاعل تتشكل مادة وسيطة، ناتجة من إضافة كاشف جرينارد إلى الاستر أو كلوريد الحمض لا تلبث أن تتحول إلى كيتون.
– ربما نلتمس من هذا التفاعل أعلاه (تفاعل جزىء من كاشف جرينارد مع الاسترات أو كلوريدات الحموض) طريقة للحصول على الكيتونات. حقاً أنه يتشكل كيتون كما في المعادلة السابقة ولكن هذه طريقة غير عملية لاصطناع الكيتونات لاسيما وقد اتضح لنا أنه قد تتشكل الكحولات من إضافة مركب جرينارد إلى المركبات المحتوية على مجاميع كربونيلية، وبناء على ذلك فإن الكيتون المتكون من إضافة جزىء من كاشف جرينارد إلى استر الحمض أو كلوريده سيتفاعل في خطوة أخرى مع الزيادة من مركب جرينارد ويتشكل الكحول الثالثي.
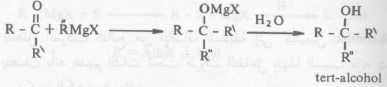
– وبالرغم من أنها طريقة قد تكون عامة للحصول على الكثير من الكحولات الثالثية إلا أنه أن نتذكر أنه لم يكن بإمكاننا استخدامها للحصول على كحولات ثالثية تحوي ثلاث مجاميع هيدروكربونية مختلفة. ولكن هذه المركبات الأخيرة ولاشك يمكن أن تحضر من إضافة مركب جرينارد إلى كيتون غير متماثل (به مجموعتين هيدروكربونية مختلفة). وبالطبع لابد وأن تكون المجموعة الهيدروكربونية في كاشف جرينارد المستخدم تختلف عن المجموعتين المؤلفة للكيتون المتفاعل معه مثل:
رابعاً/ تفاعل كواشف جرينارد مع النيتريلات
– حيث أن ذرة النيتروجين أكثر سالبية كهربية من ذرة الكربون (لاحظ جدول السالبية الكهربية السابق) عندئذ فإن مجموعة النيتريل تتأين على النحو التالي:
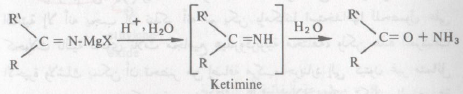
– ولهذا السبب فإن كواشف جرينارد تضاف إلى هذه المجموعة بنفس الطريقة التي تضاف بها إلى مجموعة الكربونيل
– يتحلل المركب الناتج من الإضافة السابقة إلى كيتيمين Ketimine هو الأخير يتصف بأنه عديم الثبات تحت ظروف التفاعل ولهذا السبب فإنه يتحلل مائياً إلى مركب الكيتون المطابق.
– يستفاد من الطريقة السابقة في الحصول على الكيتونات ولكن لا تطبق لتحضير الكيتونات عندما تكون كل من R و R‵ مجاميع هيدروكربونية حيث أن هناك طرق عدة وسهلة للحصول على الكيتونات ولكن فائدة هذه الطريقة أعلاه تطبيقها الواسع في الحصول على حموض بيتا كيتو β -keto- acids وأستراتها ونورد المثل التالي للتوضيح :
خامساً/ تفاعل كواشف جرينارد مع الأكسجين أو الكبريت :
– عند إمرار الأكسجين في محلول الايثر لمركب جرينارد ثم إضافة حمض مخفف. فإن هذا يؤدي إلى تكون كحول أو فينول تبعاً للمجموعة الهيدروكربونية الموجودة أصلاً في کاشف جرينارد.
– وبنفس الطريقة يتفاعل الكبريت وينشأ ثيوكحول أو ثيوفينول.
الاحتياطات اللازم توفرها عند تحضير واستعمال كواشف جرينارد
– لاحظنا حتى – الآن التفاعلات العديدة لهذا الكاشف واستخدامه في التحضير المعملي لكثير من المركبات العضوية إلا أن الأمر يلزمنا أن نوجز عن بعض الأسباب التي تعوق هذا الكاشف في كثير من الأحيان عن أداء هذا الغرض.
يجب دراسة واختيار المواد التي سنبدأ بها في عمليات التحضير.
فعندما نريد تحضير كحول مثلاً، وليكن ۲ – فينل – ۲ بيوتانول، فيلزم لنا كما رأينا، توفر كل من كاشف جرينارد والكيتون المطابقين وبدون شك فإن كاشف جرينارد يحضر من الهاليد العضوي المطابق فننظر إذا بعين الاعتبار إلى كل من المادتين الكيتون والهاليد العضوي وهل هما متوفرين أو أن الهاليد العضوي غير متوفر أو الكيتون كذلك يمكننا، إن تعذر ذلك، تدبر الأمر للحصول على طريق أيسر من تحضير ٢ ـ فينل – ۲ – بيوتانول phenyl-2-butanol-2 تبعاً للآتي
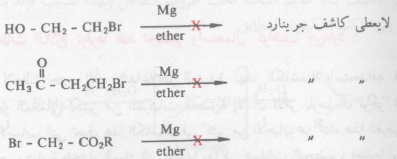
– وبالطبع لقد رأينا أن كاشف جرينارد يتفاعل مع المواد المحتوية على هيدروجين مرتبطة بذرة أكسجين، نيتروجين، كبريت، كما أنه يضاف إلى مجموعة الكربونيل والسيانيد فيجب أن نتذكر أن مثل هذه المجاميع لو وجدت في الهاليد العضوي الذي يراد تحضير كاشف جرينارد منه، فإنه عندئذ لا يتسنى لنا الحصول على کاشف جرينارد.
– فلم يكن بإمكاننا الحصول على كاشف جرينارد من الهاليدات العضوية السابقة الذكر، لأنه بمجرد تكوين الكميات البسيطة منه ستتفاعل مع المجموعة الفعالة الأخرى الموجودة في جزئ الهاليد العضوي أصلاً (مجموعة الهيدروكسيل، الكربونيل، مجموعة الاستر على التوالي). أحياناً ربما يسهل التغلب على مثل هذه المشكلة وذلك بحماية وصيانة المجموعة الفعالة ففي الهاليد العضوي الذي يحوي مجموعة كربونيل يمكن حمايتها بتكوين مشتق الأسيتال لها ثم يتهيأ لنا بعد ذلك الحصول على كاشف جرينارد، نستمر في عملية التحضير ويمكن التخلص في النهاية من مجموعة الأسيتال acetal لاستعادة مجموعة الكربونيل.
ويجب ملاحظة أيضاً:
– وحيث أنه لا يمكن تحضير كاشف جرينارد من الهاليدات العضوية التي بها مجاميع فعالة يمكنه التفاعل معها. وحتى إن مثل هذه المركبات التي يتفاعل معها لا تصلح لأن تكون مذيبات أثناء إجراء تفاعلاته فالكميات البسيطة من وجود هذه المواد تؤدي إلى إعاقة مثل هذه التفاعلات. وأحياناً إلى توقفها فالايثر الذي يستعمل أصلاً كمذيب ـ لتحضير الكاشف من الهاليد العضوي وفلز الماغنسيوم ـ يجب أن يجفف تماماً فلو وجدت أي كمية بسيطة من تلك المواد يمنع تكون الكاشف على الإطلاق.
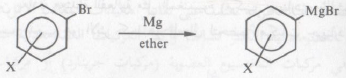
– أيضاً لا يمكن الحصول على کاشف جرينارد من هاليدات الأريل التي بها الحلقة الأروماتية تحمل مجاميع بديلة كتلك المجاميع التي تتفاعل مع كاشف جرينارد ولها القدرة على تحلله:
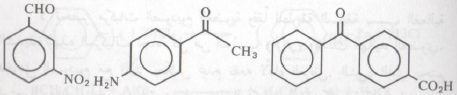
لا يحدث تفاعل عندما تكون : X = -CO2H, C = O , -OH , -CO2R , -NH2 , -CN , SO3H , NO2
يحدث تفاعل عندما تكون : (X = R , -OR , Ar (Aryl
– والجدير بالذكر أن مجموعة النيترو تعمل على أكسدة كاشف جرينارد مما يؤدى إلى تحلله. ولنفس السبب يعلل عدم إضافة كاشف جرينارد إلى مجاميع الكربونيل في المركبات الآتية:
يجب أن تدرس مثل الاحتياطات السابقة قبل بدء التجربة وذلك بإمكانية إدراك الحالات التي ربما يتيسر حدوثها كما هو الحال في أي نوع آخر من أغراض التحضير المعملية الأخرى.
المراجع: الكيمياء العضوية / د.حسن محمد الحازمي / الجزء الثاني