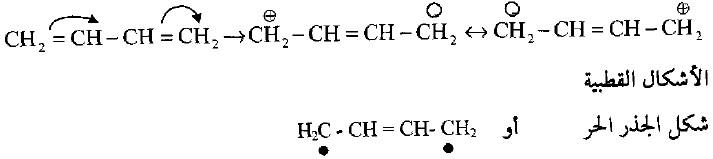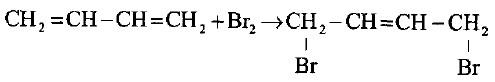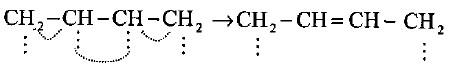الرنين فى الدايينات Resonance in Dienes
– فى هذا الموضوع سيتم مناقشة موضوع الرنين خاصة فى الدايينات Dienes ( الألكينات الثنائية).
مفهوم الرنين Resonance
– هناك مركبات عضوية لا يمكن تمثيلها بتركيب محدد واحد بل أن هنالك عدداً من المركبات النظرية الافتراضية لها وهو ما يزيد من استقرارها وتواجدها سيما تلك التي تحتوي على رابطة مزدوجة أو ثلاثية، وأن هنالك مركباً واحداً من بين كل هذه التراكيب يكون الأقل طاقة والأكثر استقراراً.
– تستخدم هذه التراكيب النظرية فقط لتوضيح ميكانيكية التفاعلات الكيميائية.
– الأوليفينات المعوضة مثل كلوريد فاينيل (CH2-CHCl) تظهر استقطاباً ناتجاً من قطبية ذرة الهالوجين وعزماً قطبياً (1.44 D) بينما يعمل الكلور نتيجة لتأثيره الميزومري السالب على الاستقطاب نحو الرابطة المزدوجة C = C وعلى النحو التالي:
– هذا التركيب القطبي ناتج من تداخل الزوج الالكتروني غير المرتبـط علـى ذرة الكلور والزوج الالكتروني π للرابطة المزدوجة مما يؤدي إلى تقصير طول الرابطة بين ذرتي الكلور والكربون المجاورة من 1.77°A إلى 1.69°A مما يجعلها أقرب إلى الرابطة المزدوجة.
– نتيجة لعدم ثبات أو لا تموضع هذا الزوج الالكتروني غير المرتبط فأن أي من هذه التراكيب هو ليس التركيب الحقيقي وإنما هنالك تركيبـاً يقع بين هذين التركيبين (التركيب الرنيني الهجين) والذي يجمع صفات التركيبين النظريين.
– هذه الظاهرة تدعى بالرنين (الميزومرية – التناظرية)، وتدعى الجزيئة عند ذاك بالحالة الميزومرية (تفسير إنكولد وارندت Ingold, Arndt).
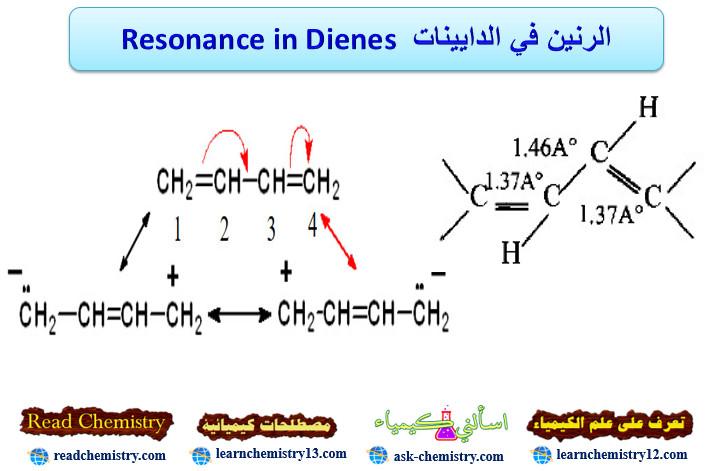
– الرنين يوضح تركيباً محدداً يعتبر الوسط بين عدة تراكيب محتملة ويربط بينها بسهم ذو رأسين.
الرنين فى الدايينات Resonance in Dienes
أطوال الروابط فى البيوتادايين
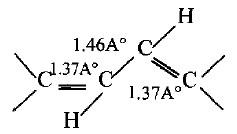
– تتضح أهمية الرنين عند زيادة عدد التراكيب الافتراضية لأي مركب إضافة إلى قياسات أطوال الروابط الأحادية والثنائية للمركبات موضوع البحث لذلك فأن طول رابطة C3 ، C2 في البيوتادايين هو Ao1.46 بينما تكون طول C-C. الرابطة الأحادية – هو 1.54 Ao (أي أنها أقرب للرابطة المزدوجة).
– الأمر الذي يؤكد أن هنالك نوعاً من التأثير بين الكترونات π لذرات كربون C3 ، C2 وبتأثير من الرابطتين المزدوجتين قد أدى إلى زيادة صفة الرابطة المزدوجة إلى C3-C2.
– أما الروابط المزدوجة الطرفية للبيوتادايين فأن أطوالها 1.37°A وهي أطول بقليل من الرابطة الثنائية Ao1.34، لذا سوف نفترض أن الكتروني π على ذرات الكربون C4 ، C1 لها تأثير قليل على بعضها البعض.
– كما يمكن الاستنتاج أن التركيب الحالي للبيوتاداين سوف لن يمثل الحالة للبيوتادايين الحقيقية سيما وأن روابط π لا يمكنها التموضع بشكل تام.
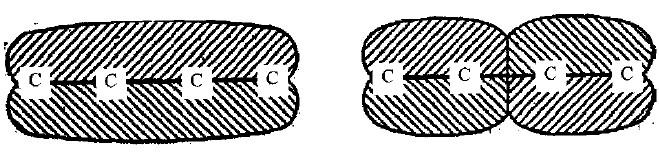
تمثيل الأفلاك الجزيئية للبيوتادايين
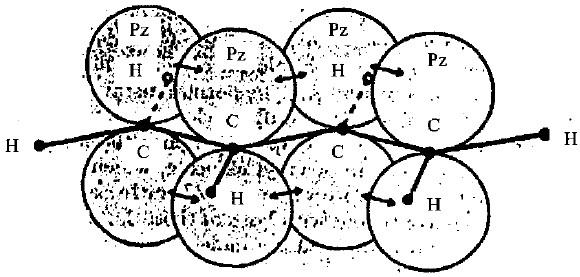
– عند تمثيل الأفلاك الجزيئية للعلاقة بين روابط البيوتادايين نجد أن ذرات الكربون تكون وفق تهجين Sp2 الهرمي الثلاثي (Trigonal).
– ونظراً للتداخـل بـين أفلاكها المهجنة Sp2 فأن ذرات الكربون ترتبط فيما بينها وكذلك مع ذرات الهيدروجين بروابط سيجما (σ) حيث يكون هنالك احتمالين للترتيب الفضائي حول الرابطة المركزية الأحادية وهما ترتيب سز وترانس والذي يكون فيه الأخير هو الأكثر استقراراً.
– أما أفلاك Pz الأربعة والعمودية على مستوى روابط (σ) فتكون متساوية وتتداخل أحداهما مع الأخرى لتكوّن فلكين جزيئيين تشغل من قبل الكترونات π يكون أحدهما ممتد على طول السلسلة بشكل منتظم بينما يكون الآخر ممتد وبشكل منفصل على كل ذرتي كاربون مكونة للرابطة الثنائية.
– توضح هذه التأكيدات على أن خير تمثيل الجزئية البيوتاديين بصفتها هجين رنيني هو كما يلي:
– والشكلين القطبين وشكل الجذر الحر تمثل وإلى حد قليل الجزيئة في الحالة المستقرة ولكن هذه الأشكال هي على قدر كبير من الأهمية في الحالة المثارة، لذا فأن الحالة المستقرة للبيوتاديين لها طاقة أقل من الحالات الرنينية وهذا ما يؤكده السلوك الكيميائي الحراري للبيوتاديين.
ميكانيكية إضافة 1،2 و 1،4 للبيوتاديين
Mechanism of 1, 2 and 1,4- addition
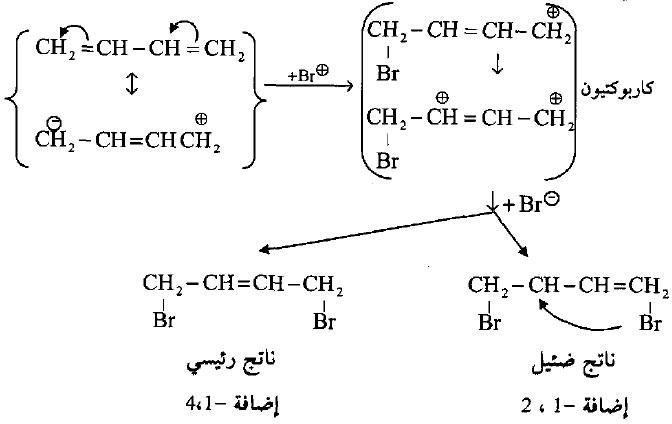
– أن إضافة البروم والهيدروجين وكلوريد الهيدروجين وبروميد الهيدروجين إلى الروابط الثنائية المتباعدة (المنفصلة) مثل بنتا -1، -4 دايين يكون مشابهاً لإضافة هذه الكواشف إلى الرابطة الثنائية الواحدة ولكن في الدايينات المقترنة فأن الإضافة تأخذ مساراً آخر مختلف تماماً.
– فقط لوحظ في إضافة البروم إلى البيوتادايين إن ذرة البروم الأولى تضاف أسرع من ذرة البروم الثانية لتكوين ثنائي البروميد.
– وأن ذرة البروم الأولى تفضل الإضافة إلى طرفي الجزيئة (مواقع 4،1) وتكوين المركب 4،1- ثنائي برومو -2- بيوتين.
– وفي هذا التفاعل فأن رابطة ثنائية جديدة ستتكون بين C3 ، C2 ، لذا سمي تفاعل الإضافة هذا بإضافة -4،1:
– وقد فسر العالم ثييل (Thiele) في بادئ الأمر هذه الإضافة على أساس نظريته للتكافؤ حيث تساهم ذرتي كربون C3 ، C2 في تكوين الرابطة الثنائية من خلال المشاركة في التكافؤات الجزئية للروابط المزدوجة المقترنة.
وعلى العموم فقد فشلت هذه النظرية في تفسير الحصول على إضافة 2،1- (كمية قليلة) بجانب 4،1- خاصة في إضافة البروم إلى البيوتاديين.
– لعل التفسير العلمي والصحيح في إضافة البروم إلى البيوتاديين وفق إضافة 4،1- إلى أن إضافة +Br تكون أولاً إلى أحدى الأطراف الفعالة للنظام المقترن والذي يؤدي إلى تكوين كاربوكاتيون له القدرة على الانتقال والطنين وبالتالي إضافة –Br إلى ذرة الكربون الموجبة لتكوين مركبي 4،1- ثنائي برومو – 2 بيوتين و 2،1- ثنائي برومو -3- بيوتين.
– تحدث نفس الإضافة في تفاعل الهيدروجين حيث يكون ناتج إضافة 4،1- بحدود 80% بينما لا يؤلف ناتج إضافة 2،1 أكثر من 20% أما الأيزومر 1- كلورو – 3- بيوتين فلا يمكن تكونه لأن ذرات الكربون المركزية لا يمكنها أن تكون مركزاً للشحنة السالبة ولذلك لا يمكنها إستقطاب البروتون في الخطوة الأولى.
قواعد الرنين Resonance and its Rules
– يعرف الرنين (الطنين) بأنه الحالات التركيبية النظرية لمركب عضوي والتي يمكن أن يتواجد بها نظرياً من أجل معرفة ميكانيكية التفاعل التي تمر بها المركبات المتفاعلة للوصول إلى الناتج النهائي.
– لأجل معرفة الضوابط التي يجب الالتزام بها عند اعتماد هذه التراكيب لابد من التقيد ببعض القواعد والبديهيات العلمية والترتيب الالكتروني للذرات وهي كما يلي:
(1) يحدث الرنين عندما يكون في المركب رابطتين ثنائية في الأقل أو رابطة ثنائية وزوج الكتروني غير مرتبط في حالة اقتران (تبادل). ويختلف التركيبان الرنينيان فقط في انتشار الكترونات π بينما تبقى الذرات في مواقعها وكذلك الروابط الأحادية (مبدأ فرانك – كوندون Frank – condon Principle).
(2) يجب أن يكون عدد الإلكترونات غير المزدوجة متساويا في جميع التراكيب.
(3) البنائات الرنينية هي بناءات افتراضية نظرية ليس لها وجود فعلي كمركبات بالرغم من اتفاقها مع قواعد وضوابط التركيب الكيميائي، أما التركيب الحقيقي فهو تركيب هجين (Resonance hybrid) بين كل التراكيب المفترضة.
(4) كلما ازداد عدد التراكيب التي يمكن رسمها وكانت متكافئة أو متقاربة في الطاقة كلما ازداد ثباتها واستقرارها وطاقتها الرنينية ويكون التركيب الحقيقي للجزيئة هو الأقرب للتركيب الأكثر ثباتاً واستقراراً.
(5) يتم الاعتماد على قواعد عامة عند تقدير استقرار التراكيب الرنينية مثل مبدأ فصل الشحنات وابتعادها عن بعضها البعض وكذلك إمتلاك كل ذرة العدد المطلوب من الالكترونات لإشباع فلكها الخارجي إضافة إلى عدم وضع الكترونات أو شحنة سالبة على ذرة ذات سالبية كهربائية قليلة والعكس صحيح.
(6) ضرورة أن تكون ذرات الجزيئة واقعة في مستوى واحد من أجل انسيابية وانتشار الالكترونات في أفلاك؛ والتي يجب أن تكون متوازية وبعكســه سـوف لن يتم التداخل.
المراجع
- الكيمياء العضوية الإليفاتية – د/ عادل شاكر الطائي – دار المسيرة للنشر والتوزيع – عمان – الأردن – 2009
- أسس الكيمياء العضوية . وائل غالب محمد – وليد محمد السعيطي ، الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States