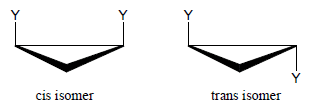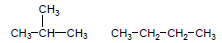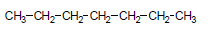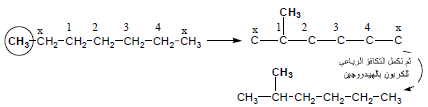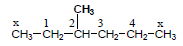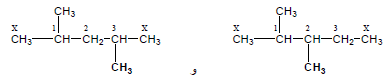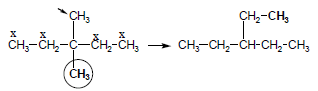التشكل في الألكانات Isomerism in alkanes
التشكل البنائي في الألكانات Structural isomerism in alkanes
– أن التشكل البنائي Structural isomerism ظاهرة واسعة الانتشار في المركبات العضوية وتعنى وجود اكثر من صيغة بنائية لصيغة جزيئية واحدة.
– ينقسم التشكل البنائي عموماً إلى ثلاث أنواع كما يلي:
(1) متشكلات السلسلة Chain isomerism
(2) المتشكلات الموضعية Positional Isomerism
(3) متشكلات المجموعة الوظيفية Functional Isomerism
– ولكن في الألكانات يوجد نوعين فقط هما متشكلات السلسلة أو المتشكلات الموضعية.
أولاً/ المتشكلات الهيكلية Skeletal isomers
– تعرف إيضاً باسم متشكلات السلسلة Chain isomerism
– المتشكلات الهيكلية هى متشكلات لها نفس الصيغة الجزيئية ولكن تختلف في الهيكل الكربوني
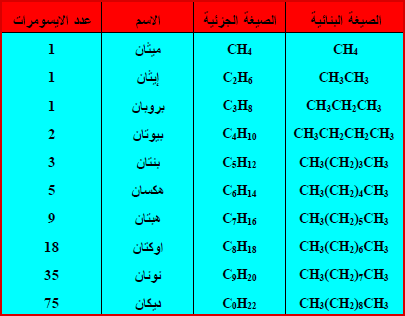
– مثال: الصيغة الجزيئية C4H10 يكون لها الصيغتين البنائيتين التاليتين كما يلي:
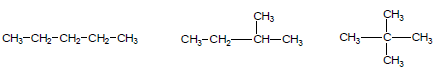
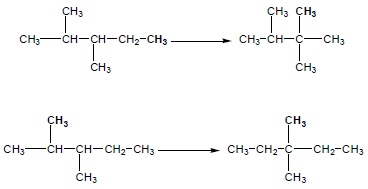
مثال (1): ماهي المتشكلات الهيكلية للصيغة الجزيئية C5H12 ؟
– لإيجاد المتشكلات يجب تحديد نوع الألكانات أولاً خلال التعويض في القانون العام للألكانات الحلقية وغير الحلقية. من الصيغة الجزيئية n= 5
– ينطبق عليها القانون العام للألكانات غير الحلقية وهذا يعنى أن جميع المتشكلات غير حلقية.
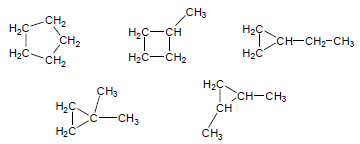
مثال (2): ماهي المتشكلات المتوقعة للصيغة الجزيئية C5H10 ؟
لا ينطبق عليها القانون العام للألكانات غير الحلقية.
ينطبق عليها القانون العام للألكانات الحلقية أي أن جميع المتشكلات تكون حلقية.
ملاحظات هامة:
– يطلق على المتشكلات اسم isomers المشتق من اللغة اليونانية isos+meros وتعنى “تتكون من نفس الأجزاء”.
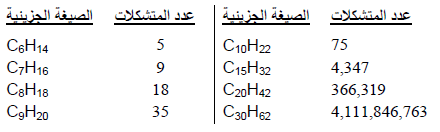
– يزداد عدد المتشكلات بزيادة عدد ذرات الكربون في الصيغة الجزيئية والجدول التالي يوضح عند متشكلات الألكانات الممكنة لبعض الصيغ الجزيئية.
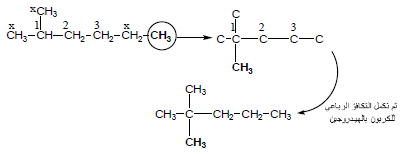
مثال (3): ماهي كل المتشكلات المتوقعة للصيغة الجزيئية C7H16 ؟
– ينطبق عليها القانون العام للألكانات غير الحلقية ويكون المتشكل الأول هو سلسلة غير متفرعة.
– من المتشكل الأول نوجد المتشكل الثاني بتغيير موقع احدى مجموعات CH3 الطرفية حيث تستبعد ذرة الكربون المجاورة لها والطرفية فيكون هناك أربع مواقع يمكن استبدال المجموعة عليها كما يلي:
– ولإيجاد المتشكل الثالث ننقل مجموعة CH3 على ذرة الكربون رقم (2) بنفس الطريقة كما يلي:
– وعند وضع المجموعة في الموقع رقم (3) يكون هو نفس المتشكل الثالث ولكن مع اتجاه معاكس وكذلك عند وضعها على ذرة الكربون رقم (4) يكون نفس المتشكل الثاني لذا يجب إيجاد باقي المتشكلات الأخرى من أحد المتشكلين الثاني أو الثالث فمثلاً من المتشكل الثاني وبنفس الطريقة نستبدل مجموعة CH3 البعيدة عن التفرع كما يلي:
– من المتشكل السادس نوجد المتشكل السابع والثامن بنفس الطريقة كما يلي:-
– ومن المتشكل الثامن نحصل على المتشكل التاسع كما يلي:-
الفرق بين النظائر والمتشكلات
– النظير Isotopes: هي ذرات لأي عنصر لها نفس العدد الذري ولكنها تختلف في عدد النيوترونات.
– المتشكل Isomerism: هو جزئ له نفس الصيغة الجزيئية لجزئ أخر يختلف عنه في الصيغة البنائية.
ثانياً/ المتشكلات الموضعية Positional isomerism
المتشكلات الموضعية هي متشكلات تختلف في موضع المجموعة غير الكربونية أو في موضع المجموعة الوظيفية من دون تغيير في الهيكل الكربوني.
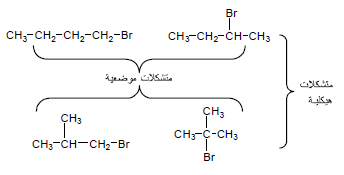
مثال (4): ماهي متشكلات الصيغة الجزيئية C4H9Br ؟ ثم وضح أى منها تمثل متشكلات موضعية وأي منها تمثل متشكلات هيكلية؟
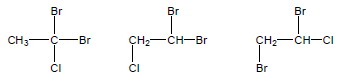
مثال (5): ماهي جميع المتشكلات الموضعية للصيغة الجزيئية C2H3Br2Cl ؟
التشكل الفراغي في الألكانات Stereochemistry of Alkanes
– التشكل الفراغي عموماً هو فرع من فروع الكيمياء الذي يهتم بدراسة الشكل ثلاثي الأبعاد للجزيئات Three-dimensional الناتج عن وضع الجزيء في الفراغ .
– ينقسم التشكل الفراغي عموماً إلى نوعين كما يلي:
- التشكل الهندسي Geometric isomerism
- التشكل الضوئي Optical isomerism
– ولكن في الألكانات يوجد نوع واحد فقط وهو التشكل الهندسي
هيئات الألكانات Conformations of Alkanes
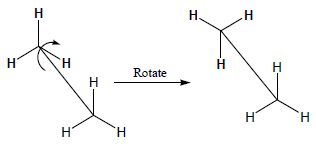
– توجد في الألكانات غير الحلقية حيث يكون الدوران حول الروابط C-C دوران حر أي غير مقيد free rotation بمعنى أن ذرات الهيدروجين أو المجموعات المتصلة بذرات الكربون تكون في حالة تبادل مستمر بين الهيئات الممكنة بسرعة كبيرة.
– لا تمثل هذه الهيئات متشكلات وذلك بسبب صعوبة فصلها.
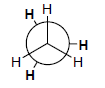
هيئات الإيثان Conformation of ethane
– يعرف هذا التمثيل للهيئات بهيئة الحصان Sawhorse representations وفية تظهر الرابطة C-C بزاوية منحرفة وروابط C-H بوضوح كبير على ذرتي الكربون.
– أن هذه الهيئات الناتجة من الدوران حول الرابطة C-C لا حصر لها وهى غير متساوية في الطاقة وبالتالي غير متساوية في الثبات وتسمى كل واحدة منها Conformer والتى اشتقت من كلمتى Conformational isomer وهناك هيئتان رئيسيتان هما:
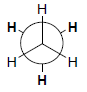
(1) هيئة الخسوف Eclipsed conformation
– وهي أقل الهيئات ثباتاً وأعلاها طاقة لأن التنافر بين أزواج الإلكترونات الرابطة يكون أعلى ما يمكن بسبب أعلى ما يمكن بسبب قرب روابط C-H من بعضها.
– التمثيل التالي يعرف بإسقاط نيومان Newman projections نسبة للعالم Melvin s.Newman وفيه تظهر الرابطة C-C مباشر من نهايتها وتمثل ذرتي الكربون بدائرة Circle
(2) هيئة الانفراج Staggered conformation
– هي أكثر الهيئات ثباتا لأنها أقل طاقة بسبب بعد الذرات أو المجموعات عن بعضها
– يوجد بين هاتين الهيئتين عدد لا حصر له من الهيئات تسمى Skew conformation
تحليل الهيئة Conformational analysis
هو عبارة عن دراسة تغيرات الطاقة المرافقة لدوران المجموعات حول رابطة احادية.
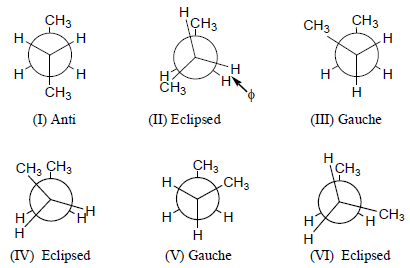
تحليل هيئة البيوتان Conformational analysis of Butane
تحليل هيئة البيوتان (الدوران حول الرابطة C2 – C3) : CH3-CH2-CH2-CH3
(1) الهيئة المتعاكسة conformation Anti:
هي الهيئة التي تكون فيها مجموعتي الميثيل متعاكستين تماماً وبناءاً علية تكون هي الهيئة الأكثر استقراراً.
(2) الهيئة المائلة Gauche conformation:
– هي الهيئة التي تكون فيها مجموعتي الميثيل متقاربتان من بعضهما أكثر من أنصاف أقطار فاندرفال مما يجعل قوى فاندرفال قوة تنافر (بسبب قرب السحب الإلكترونية في المجموعتين) وبالتالي تكون هذه الهيئة أعلى في الطاقة من الهيئة المتعاكسة وأقل ثباتاً.
– إن الهيئتين المتعاكسة والمائلة لا تحتويان على إجهاد التوائي Torsion strain وذلك لأن المجموعات تكون في وضع متبادل فتصبح أقل الهيئات في الطاقة و أآثرها استقرارا.
(3)هيئة الخسوف Eclipsed conformation
– هي الهيئة التي تكون فيها المجموعات أو الذرات في وضع متطابق أو متقابل ويوجد بها إجهاد التوائي بالإضافة إلى قوة التنافر بين المجموعات أو الذرات وبالتالي تكون الهيئة (IV) أعلى الهيئات طاقة وأقلها ثباتا.
ملاحظات هامة
أنصاف أقطار فاندرفال Van der Waals Radii
هي نصف المسافة بين النواتين عند الاتزان وتمثل نصف قطر الذرة
الأجهاد الالتوائي Torsion strain
– كان يعرف سابقاً بإجهاد بيترز Pitzer strain
– ينشأ هذا الإجهاد عند وجود مجموعتين X , Y مستبدلتين على ذرتين كربون متجاورتين C1 , C2 وتكون كل منهما على زاوية الدوران أو الالتواء ∅ Dihedral angle بحيث تكون قيمة الزاوية 60 <∅ < 0
– يكون الإجهاد الإلتوائي أعلى ما يمكن عند الزاوية صفر.
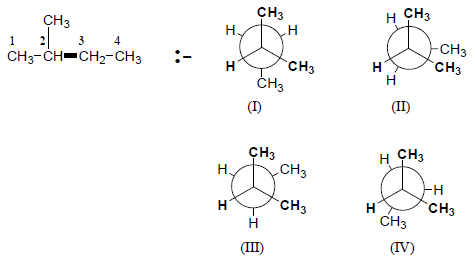
مثال محلول: ارسم اسقاط نيومان هيئات المركب للدوران حول الرابطة C2-C3؟ وهل محصلة العزم القطبي لها تساوي صفراً أم لا ؟ ثم وضح أي الهيئات تكون الأكثر ثباتا ؟
الحل:
التشكل الهندسي Geometric isomerism
– في الألكانات الحلقية يكون الدوران حول روابط C-C مقيد فيكون للجزيئات ذات الصيغة الجزيئية الواحدة والربط الداخلي الواحد توزيع مختلف للذر ات أو المجموعات في الفراغ.
– فإذا كانت المجموعتين على نفس الجانب من الحلقة يسمى بالمتشكل الجانبي Cis وإذا كانت على جانبين متعاكسين يسمي بالمتشكل القطري Trans