الفاعلية والتوجيه في مشتقات البنزين – المجموعات المنشطة والمثبطة
لقد درسنا سابقاً تفاعلات الاستبدال الأروماتي الإلكتروفيلي على حلقة البنزين وذلك لتحضير مشتقات البنزين الأحادية المختلفة. ويمكنك قراءة الموضوعات التالية على موقعنا:
(1) تفاعلات مشتقات البنزين Reaction of benzene derivatives
(2) تسمية مشتقات البنزين Nomenclature of benzene derivatives
أما في هذا الدرس سوف نتكلم عن الفاعلية والتوجيه في مشتقات البنزين و المجموعات المنشطة أو المجموعات المثبطة في الأستبدلات الآروماتية الإلكتروفيلية
Activating and Deactivating Groups In Electrophilic Aromatic Substitution
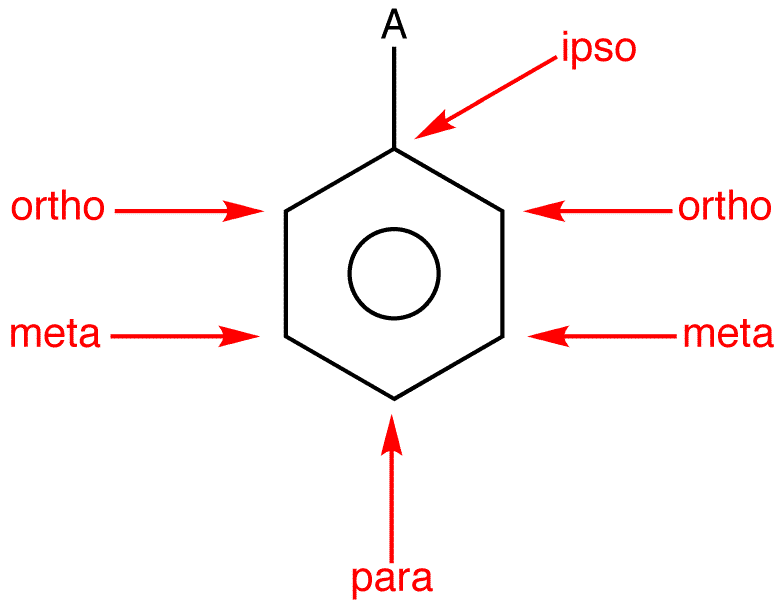
مفهوم الفاعلية والتوجيه في مشتقات البنزين
– من المثالين السابقين يتضح لنا أنه عند مهاجمة الكواشف الألكتروفيلية لحلقة البنزين فإن المجموعة المرتبطة بحلقة البنزين ليست المسئولة فحسب عن سرعة التفاعل ونشاطة، ولكنها تحدد إيضاً الموقع التى يتم عليه إحلال المجموعة البديلة الجديدة.
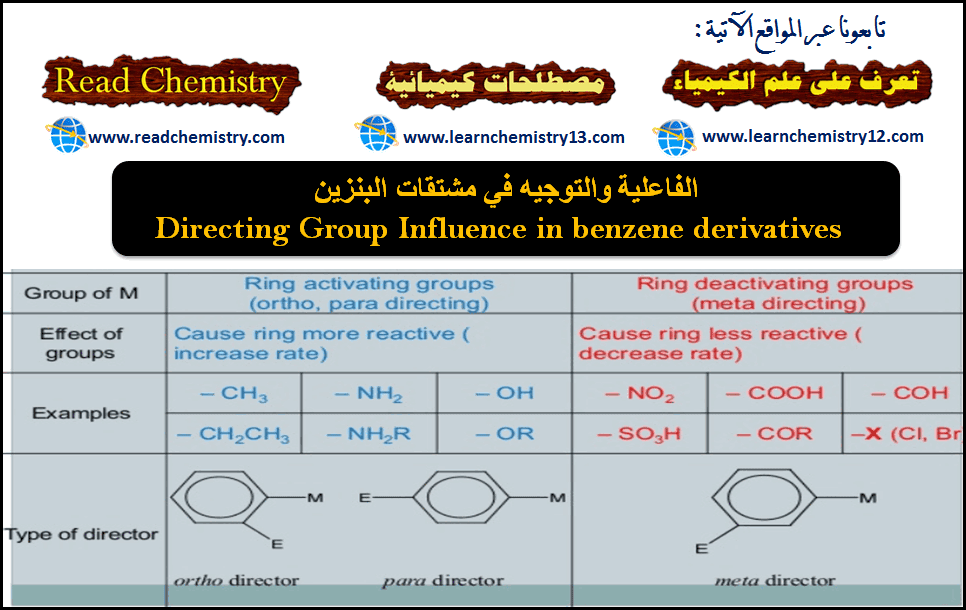
المجموعات الموجهة على حلقة البنزين
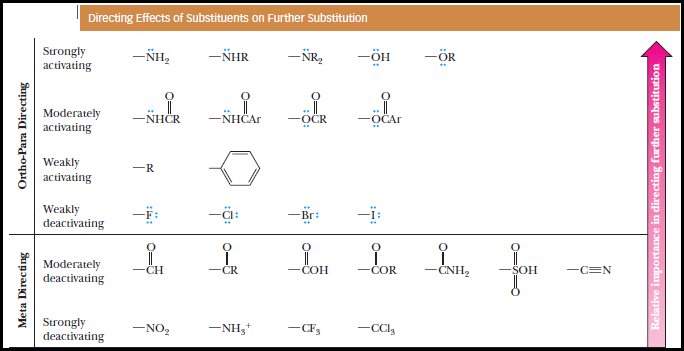
(1) مجاميع منشطة وتعمل على توجية الإلكتروفيلات للموضعين أورثو- بارا. وتشمل كلاً من المجاميع الآتية مرتبة حسب قوة تأثيرها في التوجية وتنشيط التفاعل:
حيث (R) مجموعة ألكيل Alkyl group
(2) مجاميع مثبطة وتعمل على توجية الإلكتروفيلات للموضعين اورثو – بارا. وتشمل الهالوجينات:
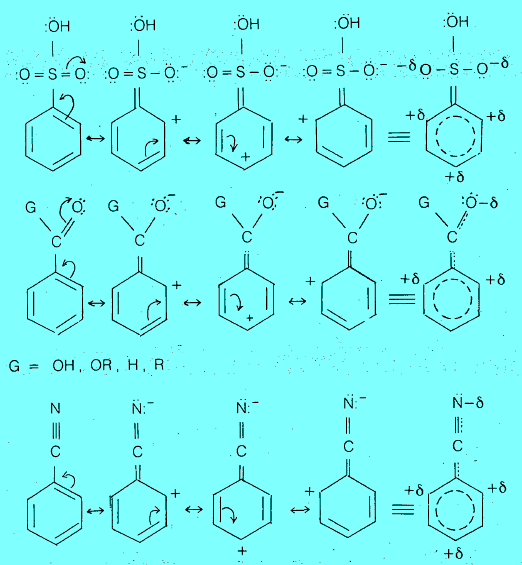
(3) مجاميع مثبطة وتعمل على توجيه الإلكتروفيلات للموضع ميتا. وتشمل كلاً من المجاميع الآتية:
ويمكن تلخيص ذلك في الشكل التالي:
تفسير ظاهرة الفعالية والتوجيه في مشتقات البنزين
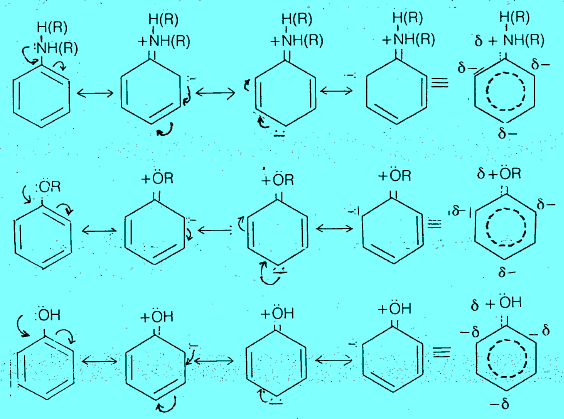
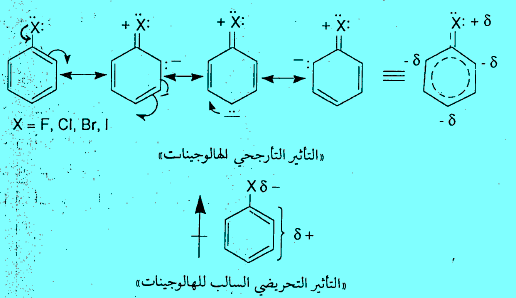
– يمكن تفسير ظاهرة الفعالية والتوجيه في مشتقات البنزين بالنظر إلى طبيعة المجموعة الاستبدالية المتصلة بحلقة البنزين. فيما لو كانت تزيد أو تقلل الكثافة الإلكترونية على الحلقة عن طريق ضخ او سحب السحابة الالكترونية على الحلقة سواءاً بالتأثير التحريضي الناتج عن الفرق في السالبية بين الذرات أو بالتأثير التأرجحى (الرنين) الناتج عن تغير موضع إلكترونات باي عن طريق الرنين.
– حيث ان المجموعة التي تعطي إلكترونات تعمل على ثبات أيون الكربونيوم الناتج عن الهجوم الإلكتروفيلي لأنها تساهم جزئياً في معادلة شحنته الموجبة. وبالتالي تنشط الحلقة تجاه الإحلال (الاستبدال) الإلكتروفيلي electrophilic substitution . بينما المجموعة التي تجذب الإلكترونات تعمل على عدم ثبات أيون الكربونيوم لإسهامها في زيادة شحنته الموجبة ، وبالتالي تثبط الحلقة تجاه الإحلال الإلكتروفيلي.
حيث (Y): مجموعة معطية للإلكترونات و تعطى إلكترونات. وبالتالي تعمل على ثبات أيون الكربونيوم لذلك تنشط الحلقة تجاه الإحلال الأروماتي الإلكتروفيلي electrophilic substitution
حيث (X): مجموعة ساحبة للإلكترونات تجذب إلكترونات وبالتالي تعمل على ثبات أيون الكربونيوم لذلك تنشط الحلقة تجاه الإحلال الأروماتي الإلكتروفيلي electrophilic substitution
أولاً/ مجاميع منشطة وتعمل على توجيه الإلكتروفيلات للموضعين أورثو- بارا
– نلاحظ من إسهام التراكيب المختلفة السابقة أن التأثير الإلكتروني أصبح متمركزاً في مواضع الأورثو – والبارا نتيجة التأرجح (الرنين) . فعندما يهاجم الكاشف الإلكتروفيلي مشتق البنزين المعطى للإلكترونات فسيوجه الإلكتروفيل إلى المواقع أورثو وبارا حيث أنها هي المواقع المتخمة بالإلكترونات.
لماذا سرعة معدل الاستبدال في الفينول أسرع منها في حالة البنزين
– تؤدى زيادة الكثافة الإلكترونية على حلقة البنزين إلى سرعة معدل تفاعل الاستبدال الإلكتروفيلي. لذلك نجد أن سرعة معدل الاستبدال في الفينول أسرع منها في حالة البنزين. فبرومة الفينول لا تحتاج إلى وجود عامل مساعد بل وقد يستلزم التخفيف بالماء للحد من عنف التفاعل. ويتم الاستبدال بسهولة نظراً للكثافة الإلكترونية العالية على الحلقة.
– هناك مجاميع أخرى تتصرف مثل مجموعة هيدروكسيل الفينول في كونها مانحة للإلكترونات وتوجه الإلكتروفيلات إلى موضعي الأورثو والبارا. ويتم فيها الاستبدال بمعدل أسرع مما هو في حالة البنزين. وتختلف هذه المجاميع في تأثيرها لقوة التوجيه باختلاف طبيعتها مثل الإيثر والأمين.
– أما بالنسبة لمجموعة الميثيل أو أي مجموعة ألكيلية اخرى متصلة بالحلقة فهي كما نعرف تنشط حلقة البنزين تجاه الإحلال الأروماتي الإلكتروفيلي وتوجه الإلكتروفيلات إلى الموقع أورثو وبارا نتيجة التاثير التحريضي الموجب للمجموعة الألكيلية حيث تعطى إلكترونات للحلقة ويكثف السحابة الإلكترونية على الموقع أورثوا وبارا وبالتالي يتم توجيه الإلكتروفيلات إلى تلك المواضع.
ثانياً/ مجاميع مثبطة وتعمل على توجيه الإلكتروفيلات للموضعين اورثو – بارا
– سبب أن الهالوجينات تعمل على جذب الإلكترونات خارج حلقة البنزين نتيجة للسالبية الكهربية العالية للهالوجينات، وهذا ما يعرف بالفعل التحريضي السالب.
– الفعل التحريضي السالب للهالوجينات يعمل على تكثيف الشحنة الموجبة على أيون الكربونيوم الناتج من الهجوم الإلكتروفيلي على الحلقة. لذلك يجعل أيون الكربونيوم أقل ثباتاً. وبالتالي يعمل على إبطاء التفاعل ولكن الهالوجين في الوقت نفسة يعطي إلكترونات للحلقة نتيجة التأثير التأرجحى. وبذلك يوجه الإلكتروفيلات إلى المواقع أورثو وبارا.
تفسير سرعة وتوجيه التفاعل الأروماتي الإلكتروفيلي في ألكيلات البنزين
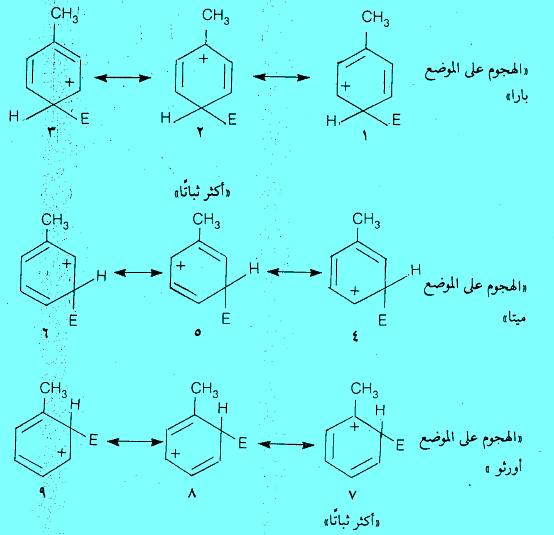
– في حالة الطولوين نجد أن الهجوم على الموضع بارا يمكن تمثيله بالهجين للتراكيب من (1-3) . وبالنسبة للموضع ميتا هجين للتراكيب من (4-6) . أما في الوضع الأورثو فيمكن التمثيل عنه بالهجين للتراكيب من (7-9) كما في حالة البارا. ونجد أن التركيبين 2 ، 7 هما الذين توجد بينهما شحنة موجبة على ذرة الكربون التى تحمل مجموعة الميثيل.
– بالرغم من أن مجموعة الميثيل (-CH3) تمنح الإلكترونات إلى جميع المواضع في الحلقة إلا أنها تعمل على منح الإلكترونات بكمية أكبر إلى ذرة الكربون المجاورة لها. وبالتالي يكون التركيبان 2 ، 7 أكثر ثباتاً من التراكيب التأرجحية الأخرى .
ثالثاُ: مجاميع مثبطة وتعمل على توجيه الإلكتروفيلات للموضع ميتا
أمثلة على تفاعلات الاستبدال الأروماتي الإلكتروفيلي مع مشتقات البنزين
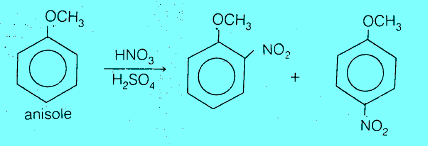
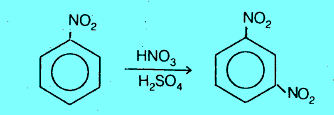
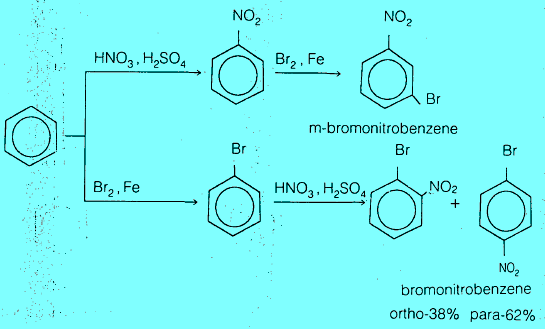
(1) تحضير أورثو وبارا و ميتا نيتروبنزين O, p , m-bromonitrobenzene
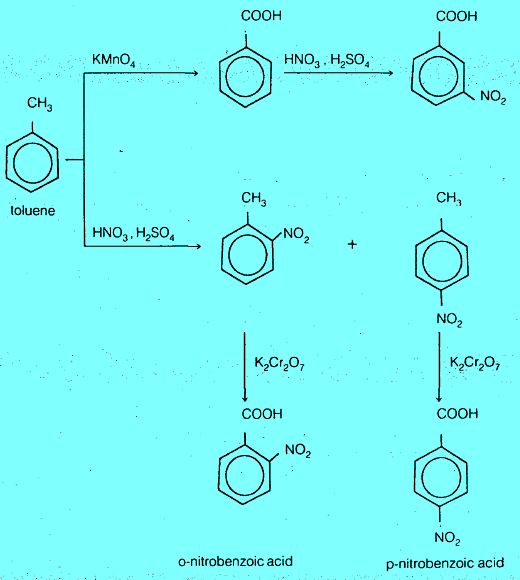
(2) تحضير حمض نيتروبنزويك من الطولوين
أن الناتج النهائي لتحضير حمض نيتروبنزويك من الطولوين يعتمد على نيترة الطولوين أولاً ثم أكسدته أو العكس. حيث يعطى التفاعل الأول البارا والأروثوا بينما نحصل على ميتا حمض بنزويك عند أكسدة الطولوين أولاً يلي ذلك نيترة الناتج.
يجب التنويه على أنه يمكن فصل الأورثو عن البارا في معظم الحالات بطرق الفصل المألوفة مثل التقطير التجزيئي والترسيب التجزيئي (إعادة البلورة) وغيرها.
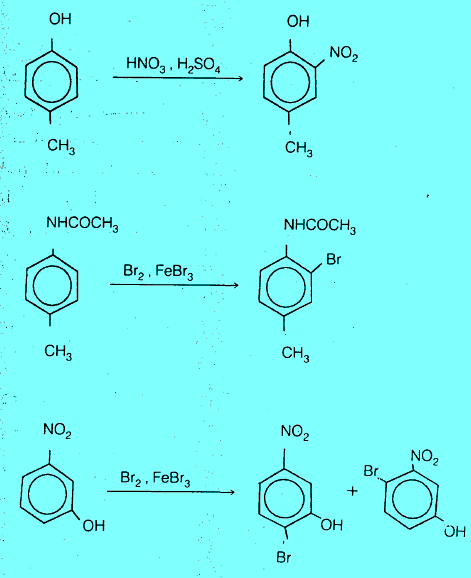
الفعالية والتوجيه في حالة البنزين ثنائي المجاميع
– في حالة البنزين ثنائي المجاميع البديلة نجد أن المجاميع شديدة التنشيط (مثل –NH2 , -OH) هي دائماً التي تحدد موضع الهجوم الإلكتروفيلي مقارنة بالمجاميع المثبطة مثل (-NO2) أو بالمجاميع ضعيفة التنشيط (مثل –CH3)
– الفرق في قوة المجاميع الموجهة تخضع للترتيب الآتي:
– يمكن توضيح ذلك كما يلي:


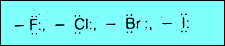
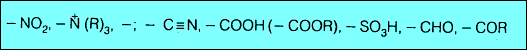



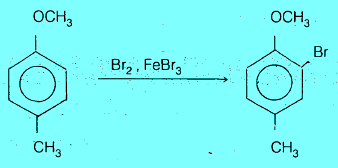



شكراً لك على هذا المجهود الكبير
بوركت