تعريف المذيبات العضوية Organic Solvent
المذيب عبارة عن سائل يستخدم في إذابة المركبات وتعتبر المذيبات مهمة جداً في التجارب العملية حيث أنها تؤثر على حمضية وقاعدية المحاليل لذا يجب فهم الذوبانية ودور المذيب وتأثيراته على معدلات التفاعل قبل اختياره ولفهم هذه التأثيرات يجب معرفة تصنيف المذيبات.
تصنيف المذيبات العضوية classification of solvents
(1) المذيبات البروتونية وغير البروتونية protic and aprotic
(2) المذيبات القطبية وغير القطبية polar and apolar
(3) المذيبات المانحة وغير المانحة donor and nondonor
أولاً/ المذيبات البروتونية وغير البروتونية protic and aprotic
– المذيبات البروتونية protic : هي المذيبات التى تتألف من الجزيئات التى تستطيع تكوين روابط هيدروجينية كونها تحتوي على ذرة هيدروجين حامضية مثل الماء.
– المذيبات غير البروتونية aprotic : هي المذيبات التي تستطيع جزيئاتها تكوين روابط هيدروجينية مثل الهكسان
ثانياً/ المذيبات القطبية وغير القطبية polar and apolar
– المذيبات القطبية polar : هي المذيبات التي لها ثابت عزل كهربائي مرتفع
– المذيبات غير القطبية apolar : هي المذيبات التي لها ثابت عزل كهربائي منخفض
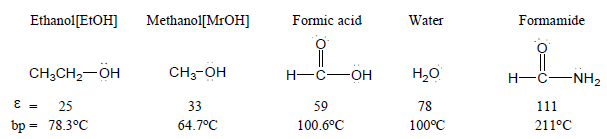
ثابت العزل الكهربائي Dielectric constant
– يعرف ثابت العزل الكهربائي بقانون الكهروستاتيكية وهو عبارة عن تأثير الطاقة الناتج عن أيونين مشحونين q1 , q2 يبعدان عن بعضهما مسافة r
حيث k= ثابت التناسب ، ε = ثابت العزل الكهربائي للمذيب.
– المذيبات القطبية تكون ذات فاعلية عالية في الفصل (حجب الأيونات عن بعضها) فتكون قوى التجاذب والتنافر
بين الأيونات ضعيفة.
– تعتمد قطبية المذيبات على قيمة ثابت العزل الكهربائي فالمذيبات التى تمتلك ثابت عزل كهربي يساوي 15 أو أعلى تكون مذيبات قطبية والتي لها ثابت عزل كهربي أقل من 15 مذيبات غير قطبية.
ملاحظة هامة
أن لكلمة قطبي polar استعمالين في الكيمياء العضوية فعندما نقول على الجزئ أنه قطبي فأننا نشير بذلك إلى العزم القطبي للجزئ (μ) وعندما نقول مذيب قطبي فأننا نعنى ثابت عزل كهربي مرتفع أو منخفض أو بعبارة اخرى الجزيئات القطبية أو العزم القطبي تكون خاصية مستقلة، والمذيب القطبي وثابت العزل الكهربي يكون خاصية عامة للجزيئات.
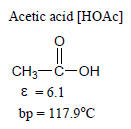
مثال: حمض الفورميك وحمض الخليك
إن هذان الجزيئان لهما نفس المجموعة الوظيفية ومتشابهان جداً في التركيب البنائي ولهما عزم قطبي متقارب وكل من الجزيئان قطبي ، ولكنهما يختلفان اختلافاً كبيراً في قيمة ثابت العزل الكهربى وبالتالى يختلفان في خواص المذيب فنجد ان حمض الفورميك مذيب عال القطبية وحمض الخليك مذيب اقل قطبية بكثير.
ثالثاً/ المذيبات المانحة وغير المانحة donor and nondonor
المذيبات االمانحة donor : هي المذيبات التي تتألف من جزيئات قادرة على منح ازواج من الإلكترونات غير المشاركة في الربط وتسمى هذه الجزيئات قواعد لويس مثل الميثانول.
المذيبات غير المانحة nondonor : هى المذيبات التى ليست قواعد لويس مثل البنتان والبنزين.
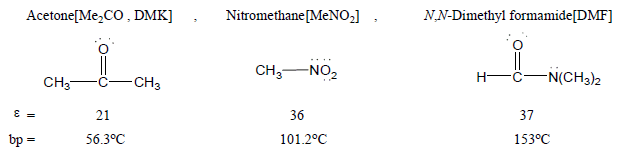
أمثلة لخواص بعض المذيبات العضوية الشائعة Common Organic solvent
(1) من المذيبات غير القطبية مثل:
(2) بعض المذيبات غير القطبية تكون مانحة ( قواعد لويس ) مثل:
(3) بعض المذيبات غير القطبية تكون بروتونية ومانحة مثل:
(4) بعض المذيبات القطبية تكون مانحة وغير بروتونية مثل:
(5) بعض المذيبات القطبية تكون مانحة وبروتونية مثل:
الذوبانية Solubility
(أ) ذوبانية المركبات التساهمية
عند اختيار المذيب المناسب للمركبات العضوية نتبع قاعدة (الشبيه يذيب الشبيه) (like dissolves like) . وهذه القاعدة تتطلب معرفة بعض مميزات المركبات العضوية من أجل إذابتها في المذيب المناسب فمثلا المذيبات القطبية غير البروتونية تكون مناسبة لإذابة المواد القطبية غير البروتونية ، وتكون المذيبات البروتونية هامة جدا من حيث مقدرتها على تكوين روابط هيدروجينية بين الجزيئات لإذابة المواد البروتونية في التفاعلات الكيميائية.
(ب) ذوبانية المركبات الأيونية
من المهم للمتفاعل الأيوني والتفاعل الأيوني نوع الوسط الذي يجري فيه التفاعل فالمركبات الأيونية لها أهمية خاصة من حيث بقاءها منفصلة في المحلول فتتحرك الأيونات في البداية بشكل مستقل فيتخذ كل أيون اتجاه الأيون المضاد له في الشحنة ثم تحاط الأيونات المفصولة بجزيئات المذيب.
قواعد ذوبانية المركبات الأيونية في الماء
(1) الفلزات القلوية وأملاح الأمونيوم تكون ذائبة تقريبا.
(2) أسيتات الفلزات والبرمنجنات والنيترات والنتريلات والكلورات والبيركلورات تكون ذائبة في الماء تقريباً.
(3) كلوريدات الفلزات والبروميدات والايودات تكون ذائبة ما عدا الفضة والزئبق (I) حيث يكون HgI2 غير ذائب و HgBr و PbCl2 تكون معتدلة الذوبان.
(4) كبريتات الفلزات تكون ذائبة ماعدا الرصاص (II) والباريوم والكالسيوم ، أما كبريتات الفضة تكون معتدلة الذوبان.
(5) هيدروكسيدات الكالسيوم والباريوم ذات ذوبانية معتدلة ، وهيدروكسيدات وأكاسيد الفلزات الأخرى تكون غير ذائبة.
المراجع: أسس الكيمياء العضوية / وائل غالب محمد – وليد محمد السعيطي / الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا

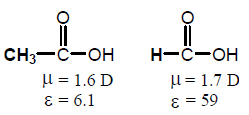

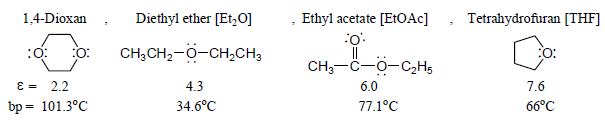






اين اجد المراجع خاصتكم؟
موجودة في قسم كتب كيميائية
كيف احصل على مراجع
أدخل موقع/ اسألني كيمياء وأكتب فى البحث كلمة مراجع أو كتب