استخدامات هاليدات الألكيل
استخدامات هاليدات الألكيل
– تستخدم هاليدات الألكيل على نطاق واسع في تحضير واصطناع الكثير من المركبات العضوية فهي تدخل في تحضير الألكانات الكبيرة (تفاعل فرتز) والألكينات والكحولات والكحولات الكبريتية والايثرات الكبريتية والأمينات والنتريلات والكيتونات (تفاعل جرينيارد) وألكيلات البنزين (تفاعل فريدل كرافت) وغيرها.
– تستخدم كلوريدات الميثيل والايثيل في تفاعل الألكلة (استبدال ذرات الهيدروجين الحامضية بمجموعة الكيلية).
– إضافة إلى ذلك فإن كلوريد الميثيل يستخدم في مركبات التكييف (Refrigerant) بينما يستخدم كلوريد الايثل في مركبات التخدير للآلام الموضعية (تجميد الأنسجة Freezing of tissue)، كما ويستخدم في الصناعة كمادة أولية في تحضير رابع أثيل الرصاص (مادة ضد الضربات Anti Knock qgent).
– وهنا سيتم ذكر بعض استخدامات أشهر مركبات هاليدات الألكيل كما يلي:
(1) كلوريد المثيلين
– هو سائل عديم اللون ذو درجة غليان o40.
– يستعمل كمذيب للأصباغ وفي صناعة اللواصق والألياف النسيجية.
(2) بروميد المثيلين
– سائل عديم اللون ذو درجة غليان o95م ويوديد المثيلين سائل عديم اللون ذو درجة غليان o181م.
– كلاهما يستخدمان في تفاعلات الاصطناع العضوي.
(3) الكلوروفورم
– هو سائل عديم اللون وحلو المذاق درجة غليانه o61م
– قليل الذوبان في الماء ويذوب تماماً في الكحول والايثر.
– لكونه يؤدي إلى فقدان الوعي فقد تم استخدامه في العمليات الجراحية كمخدر.
– عند تعرضه إلى الهواء الرطب أو الضوء فأنه يتحول إلى الفوسجين COCl2 وهو سائل عالي السمية.
– عند استخدامه كمخدر فأنه يجب أن يحفظ في قناني غامقة مع إضافة 1% من الايثانول الذي يتفاعل مباشرة مع الفوسجين المتكون لإعطاء مركب ثنائي أيثل الكاربونات غير السام (
– بتأثير حامض النتريك المركز فأن الكلوروفورم يتحول إلى نتروكلوروفورم (كلوروبكرين) والذي يكون سائلاً ثقيلاً ذو درجة غليان 112°م ويستعمل كمبيد للحشرات.
CHCl3 + HNO3 → Cl3C-NO2 + H2O
(4) الأيودوفورم
– يكون الأيودوفورم مركب صلب بلوري أصفر درجة انصهاره 199°م
– عديم الذوبان في الماء ولكنه سريع الذوبان في الكحول والايثر وله رائحة غير مقبولة.
– يستخدم كدلالة تشخيصية لوجود مجاميع الأسيل 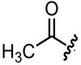
(5) رابع كلوريد الكربون
– أما رابع كلوريد الكربون CCl4 فهو سائل عديم اللون ذو درجة غليان 77°م ورائحته حلوة.
– نظراً لعدم قابليته على الاشتعال فأنه يستخدم في إطفاء الحرائق إضافة إلى استخدامه والكلوروفورم كمذيبات للشحوم والزيوت والتنظيف الجاف علماً بأن هذين المركبين يعتبران من المركبات المسببة للسرطان (Carcinogenic).
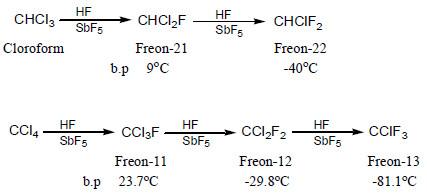
(6) الفريونات Freons أشهر استخدامات هاليدات الألكيل
– الفريونات هي عبارة عن غازات أو سوائل ذات درجات غليان منخفضة تعرف بمركبات Chloro fluoro carbons CFC ولها استعمالات واسعة فى الصناعة حيث تستخدم كمواد دافعة في علب الرش وتستعمل فى المبردات والمجمدات ومكيفات الهواء.
– يستخدم فريون 12 كمادة تبريد ويستخدم خليط من فريون 11 ، 12 ، 114 (CClF2CClF2 ) لدفع الضباب فى الهواء الجوي وكمبيد للروائح الكريهة وكرغوة للحلاقة ورذاذ للشعر وغيرها.
– كل مركبات CFC غير سريعة الاشتعال ولها بعض الكفاءة في إطفاء الحرائق ولكن المركبات الأكثر أستعمالاً لهذا الغرض هى التي تحتوي على البروم مثل CBrF3 ، CBrClF2.
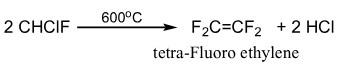
– يستخدم فريون 22 فى تحضير فلورو إيثلين المستخدم فى تحضير التفلون كما بالتفاعل التالي:
– لقد تراجع استعمال الفريونات لما لها من اضرار على طبقة الأوزون فيسبب استقرارها فهي لا تنحل ولا تتحطم كيميائياً بسهولة وتنتشر ببطئ نحو الجو فتصل إلى طبقة الستراتوسفير التى تحتوي على طبقة الأوزون المكون لعنصر الأكسجين والتى تحمي الأرض من الأشعة الفوق بنفسجية UV وعندما يمتص الأوزون أشعة UV فأنه يتحول إلى أكسجين ذري وجزئ أكسجين كما يلي:
– تعمل أشعة UV على تكوين ذرات الكلور بالجذور الحرة من الفريونات فتتخذ ذرات الكلور مع الأوزون لينتج كلور أحادي الأكسيد وجزئ أكسجين مما يؤدى على تناقص طبقة الأوزون كما يلي:
– تعمل ذرة الكلور الناتجة على تحطيم جزئيات أوزون أخري بشكل مستمر.
المراجع
- الكيمياء العضوية الإليفاتية – د/ عادل شاكر الطائي – دار المسيرة للنشر والتوزيع – عمان – الأردن – 2009
- Organic chemistry / L.G. Wade, Jr / 8th ed, 2013 / Pearson Education, Inc. USA.
- Unergraduate Organic Chemistry /Dr. Jagdamba Singh, Dr. L.D.S Yadav / 1st ed, 2010/ Pragati prakashan Educational Publishers, India.
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States