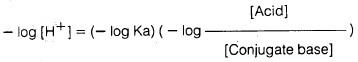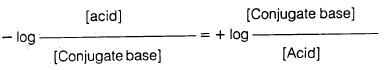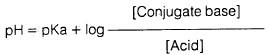الخواص الحمضية والقاعدية للأحماض الأمينية
الأحماض الأمينية كأيونات قطبية Amino acids as dipolar ions
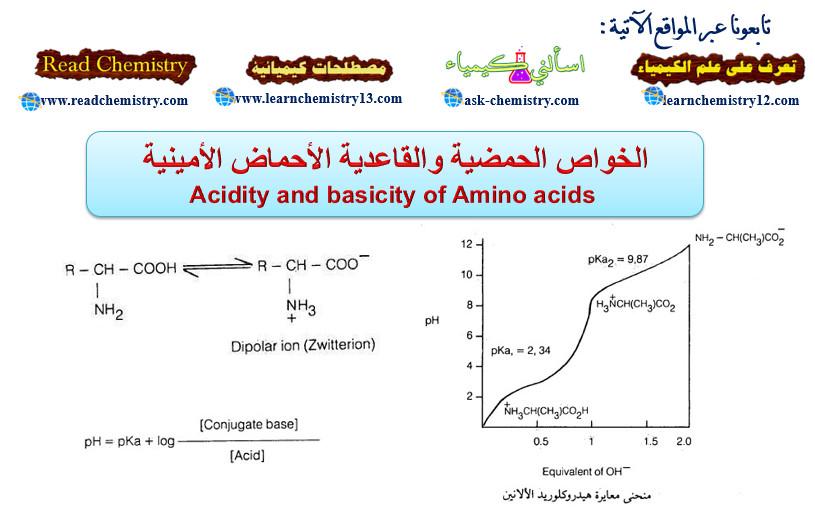
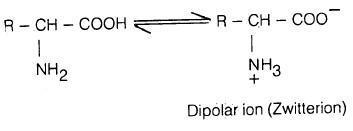
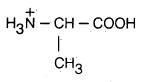
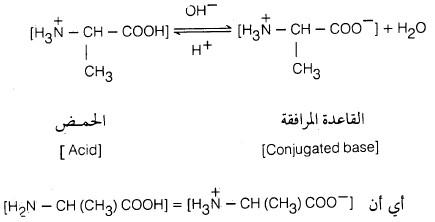
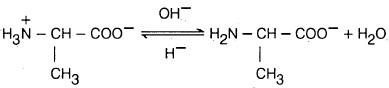
– مع أن الأحماض الأمينية فيها مجموعة أمينية ومجموعة حمضية إلا أن بعض الخصائص الفيزيائية والكيميائية لا تتوافق مع هذا التركيب وذلك أن بروتون مجموعة الكربوكسيل COOH- في تلك الأحمـاض الأمينية ينتقل إلى المجموعة القاعدية NH2– كتفاعل داخلي بين حمض وقاعدة لتتكون أحماض أمينية على هيئة أيونات ثنائية القطبية أو أملاح داخلية تسمى أيضا الأيون المزدوج (Zwitter ion).
ونظراً لوجود الأحماض الأمينية على هيئة أملاح فمن المتوقع أن تتصرف كتصرف الأملاح لذا فهي:
- صلبة ولها درجات انصهار عالية
- وكثيراً ما تتفكك تلك قبل الوصول إلى درجات انصهارها.
- كما أنها لا تذوب في المذيبات العضوية غير القطبية مثل إيثر البترول والبنزين لكنها تذوب في الماء بسهولة.
الخواص الحمضية والقاعدية للأحماض الأمينية
Acidity and basicity of Amino acids
– تظهر الأحماض الأمينية عادة الصفات الحمضية والقاعدية في المحاليل المائية لذلك فهي تمتلك الخاصية الأمفوتيرية. (أي قدرتها على التفاعل مع الأحماض وكذلك مع القـواعـد).
– يعتمـد سلوك الحمض الأميني على الوسط الذي يتوافر فيه ذلك المركب (أي قيمة درجة الأحماض pH)
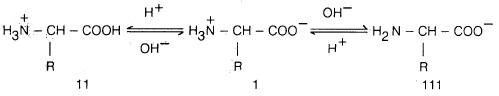
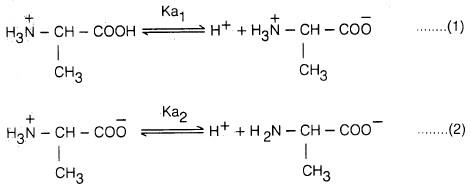
– يعتمد كذلك على طبيعة الحمض الأميني. ففي المحاليل ذات الصفة الحمضية القوية توجد جميع الأحماض الأمينية على هيئة كاتيونات (II)، أما في المحاليل القاعدية القوية فجميع الأحماض الأمينية توجد على هيئة أنيونات (III).
– وعندما تكون قيمة pH للمحلول متوسطة فتسمى نقطة التكافؤ الكهربائي (Isoelectric point) وفيها يتساوى تركيز الأنيونات والكاتيونات وذلك بأن توجد جميع الجزيئات في المحلول على هيئة أيون مزدوج (Zwitterion (I وتكون محصلة سريان الشحنات الكهربية صفراً (جميع الجزيئات متعادلة كهربائياً).
مثال لشرح الخواص الحمضية والقاعدية للأحماض الأمينية
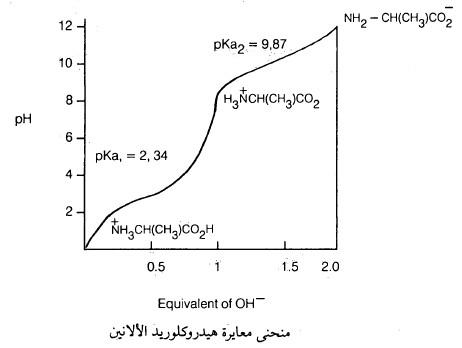
بمعاينة منحني المعايرة لمركب الألانين كما بالشكل التالي:
مثلاً نجد أنه في المحلول الحمضي القـوي (قيمة pH منخفضة) فإن الألانين يوجد بشكل رئيسي على الصورة الكاتيونية كما يلي:
وعندها فإن الملح الناتج يسلك سلوك حمض ثنائي (Dihydric acid) كما يلي:
لذلك نجد أن المحلول الحمضي (0= pH) للحمض الأميني ألانين بحاجة إلى مكافئين من القاعدة لكي تتحول جميع جزيئات الحمض الأميني الموجودة على هيئة كاتيونات إلى جزيئات الحمض الأميني على هيئة أنيونات.
فمثلاً عند البدء بإضافة نصف مكافئ من القـاعـدة فقط فإن نصف جزيئات الحمض الأميني الكاتيوني تتحول إلى ألانين (قاعدة مرافقة).
وتصبح قيمة pH في هذه النقطة مساوية لـ pka وتساوي 2.35 كما يتضح من الشكل السابق.
– إن انفصـال الـبـروتـون يـعـود إلى تأين مجمـوعـة COOH – وليست مجمـوعة NH3+– حيث إنها المجموعة الأكثر حمضية ويعود ذلك إلى القاعدية العالية لمجموعة الأمين NH2 – مقارنة بمجموعة أيون الكربوكسيل –COO- مما يقلل من قاعدية أيون – الكربوكسيل وبالتالي يسهل انفصال البروتون منها هو التأثير الإيجابي الكبير للمجموعة NH2– والموجودة على الموقع (α) بالنسبة لمجموعة أيون الكربوكسيل.
بعد اكتمال إضافة مكافئ واحد من القاعدة فإن الناتج الرئيس هو ألانين (أيون مزدوج) فقط وتكون قيمة pH في هذه النقطة مساوية لحمضية الحمض الأميني نفسه في الماء النقي وتسمى بنقطة التكافؤ الكهربي وتساوي 6.1 للألانين.
وباستمرار إضافة نصف مكافىء آخـر من القاعدة على الألانين فإن نصف جزيئات الحمض الأميني السابق تتحول إلى جزيئات الحمض الأميني الأنيوني .
وعنـدهـا تصبح قيمة pH مساوية لـ pka2 وتساوي 9,78.
تركيب الحمض الأميني في المحلول يعتمـد على قيمـة pH
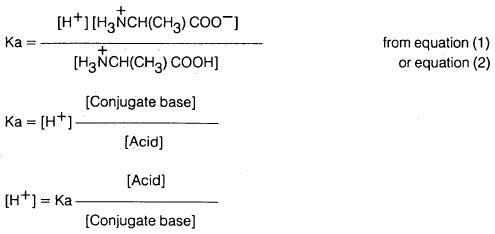
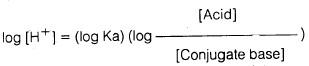
يمكن استنتاج أن تركيب الحمض الأميني في المحلول يعتمـد على قيمـة pH والتي تتبـع قيمـة pka للحمض الضعيف (ألانين) من خلال معـادلـة هـنـدرسن – هاسيل باخ (Henderson-hasselbach equation) كما يتضح من المعادلات التالية:
وبأخذ لوغاريتم كلا الجانبين في المعادلة السابقة فإننا نحصل على:
وبضرب كلا الطرفين بـ (ـ 1) نحصل على ما يلي:
وحيث إن:
وكذلك
فإن معادلة هندرسن – هاسيل باخ تصبح:
وحيث إن pka ثابتة عند درجة حرارة معينة لأي حمض من الأحماض فإن قيمة pH تتبع لنسب تركيز القاعدة المرافقة والحمض وعندما يوجد الحمض الضعيف وملحة (القاعدة المرافقة) في تراكيز متساوية، أي أن:
فإن 0 = 1 Log وتصبح قيمة pH للنظام مساوية لـ pka معادلة هندرسن – هاسيل باخ). pH = pka
المراجع: كتاب المركبات الحلقية غير المتجانسة والحيوية للدكتور حمد بن عبدالله اللحيدان. والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب – الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية