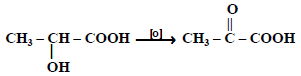الكيمياء العضوية
الأحماض الكربوكسيلية (الأحماض الهالوجينية والأحماض الهيدروكسيلية)

الأحماض الهالوجينية Halogen carboxylic acid
أولاً/ تعريف الأحماض الهالوجينية
– الأحماض الهالوجينية مشتقات للأحماض الكربوكسيلية أحادية القاعدة والتي يمكن الحصول عليها باستبدال ذرة أو أكثر من ذرات الهيدروجين (على مجموعة الكيل ) بذرة أو ذرات هالوجين

– أمثلة:
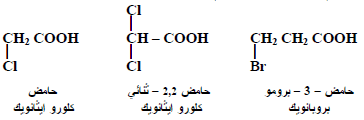
ثانياً/ الخواص الفيزيائية للأحماض الهالوجينية
physical properties of Halogen carboxylic acid
– للأحماض الهالوجينية درجات انصهار ودرجات غليان أعلى من درجات الأحماض الأليفاتية المقابلة لها .
– ويؤثر نوع وموقع ذرة الهالوجين وعددها في الحمض الهالوجيني على قوة الحمض فنرى درجة تأين الأحماض يتبع الترتيب التالي :
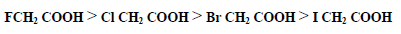
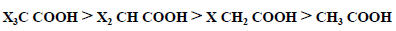
– ويمكن شرح قوة الأحماض الهالوجينية إلى ظاهرة التأثير الحثي العالية لذرات الهالوجين التي يمكن لها سحب الالكترونات وبالتالي زيادة الحامضية. وكلما بعدت ذرة الهالوجين عن مجموعة الكربوكسيل ضعفت ظاهرة التأثير الحثي وبالتالي ضعفت قوة الحمض الهالوجيني .
ثالثاً/ تحضير الأحماض الهالوجينية
Preparation of Halogen carboxylic acid
تعتمد طرق تحضير هذا النوع من الأحماض على موقع ذرة الهالوجين في الجزئ . ومن الطرق المستخدمة ما يلي:
(1) الهلجنة المباشرة
يتفاعل الكلور أو البروم مع حمض كربوكسيلي في وجود الضوء لإعطاء حمض ألفا هالوجيني وبينما تتم البرومه على ذرة ألفا فقط ، يمكن للكلورة أن تحدث على ذرة ألفا وبيتا وجاما.
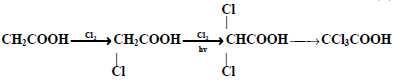
(2) من الأحماض ألفا – بيتا غير المشبعة
تحضر أحماض بيتا الهالوجينية بتفاعل هاليدات الهالوجين مثل (HBR) على الأحماض ألفا وبيتا غير المشبعة (عكس قاعدة ماركينوكوف) كما يلي :
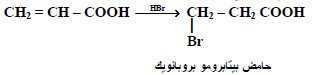
(3) من الأحماض الهيدروكسيلية :
من الطرق الناجحة لتحضير أحماض ألفا وبيتا وجاما ودلتا الهالوجينية تفاعل الأحماض الهيدروكسيلية المقابلة لها مع هاليدات الأحماض أو هاليدات الفوسفور كما يلي:
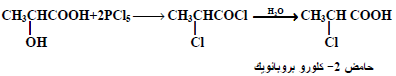
رابعاً/ الخواص الكيميائية للأحماض الهالوجينية
Chemical properties of Halogen carboxylic acid
– تظهر هذه الأحماض خواص مجموعتي الكربوكسيل وذرة الهالوجين مجتمعين فيسبب وجود الكربوكسيل COOH الساحبة للإلكترونات فإن ذرة الهالوجين تكون نشطة أكثر مما هي في هاليدات الكيل.
– لذا فإننا نجد هذه الأحماض تتفاعل لتعطي أسترات هاليدات أحماض وأميدات الخ كما يمكن استبدال ذرة الهالوجين بذرات أو مجموعات اخرى مثل: OH, -NH2, -CN–
– التفاعل مع محلول هيدروكسيد الصوديوم
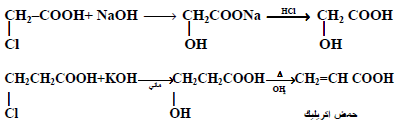
نرى أن أحماض بيتا الهالوجينية تتحول إلى أحماض بيتا الهيدروكسيلية ثم عند تسخينها في محلول قلوي تفقد بدروها جزئ ماء وتتحول إلى أحماض ألفا – بيتا غير المشبعة .
الأحماض الهيدروكسيلية Hydroxy carboxylic acid
أولاً: تعريف الأحماض الهيدروكسيلية
– الأحماض الهيدروكسيلية أحماض كربوكسيلية أحادية القاعدة حيث تكون إحدى ذرات هيدروجين مجموعة الألكيل قد استبدلت بمجموعة هيدروكسيل:

– أمثلة:

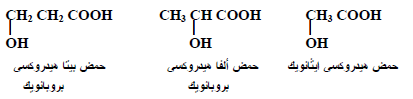
ثانياً/ الخواص الفيزيائية للأحماض الهيدروكسيلية
Physical properties of Hydroxy carboxylic acid
– الأحماض الهيدروكسيلية مواد صلبة بيضاء أو سوائل ولها ذائبية عالية في الما ء ، ولكنها لا تذوب كثيراً في الايثرات أو الكحولات ، كما أن لها درجات انصهار ودرجات غليان أعلى من درجات الأحماض الأليفاتية المقابلة لها.
– تأثير الحرارة على الأحماض الهيدروكسيلية :
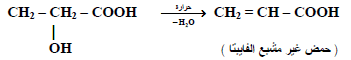
تتكون نواتج مختلفة عند تسخين الأحماض الهيدروكسيلية وذلك بسبب اختلاف مواقع مجموعة الهيدروكسيل في الحمض
ثالثاً/ تحضير الأحماض الهيدروكسيلية
Preparation of Hydroxy carboxylic acid
(1) غليان الأحماض الهالوجينية بمحلول مائي قلوي أو محلول كربونات الصوديوم المائي
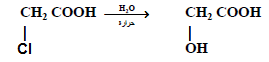
(2) تفاعل الأحماض الأمينية مع حمض النيتروز NaNO2 / HCl
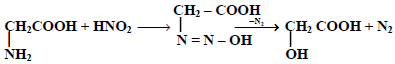
وحيث أنه يتصاعد مول واحد من غاز النيتروجين لكل مجموعة أمين موجودة في الحمض الأميني فإنه يتم استخدام عدد الطريقة لتحديد عدد مجموعات الأمين الطليقة في البروتينات.
(3) اختزال الالدهيدات أو الكيتونات الحمضية:
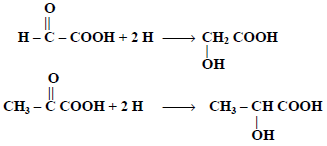
رابعاً/ الخواص الكيميائية للأحماض الهيدروكسيلية
Chemical properties of Hydroxy carboxylic acid
(1) التفاعل مع القواعد:
تفاعل الأحماض الهيدروكسلية مع هيدروكسيد الصوديوم أو كربونات الصوديوم المائية لتعطي أملاحاً:
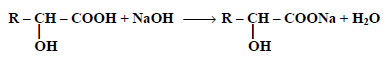
(2) التفاعل مع الكحولات
تتفاعل الأحماض الهيدروكسلية مع الكحولات لإعطاء إسترات
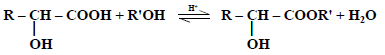
(3) التفاعل مع الأمونيا:
تتفاعل الأحماض الهيدروكسلية مع الأمونيا حيث يتكون ملح أمونيوم الذي يعطي أميد عند تسخينه.
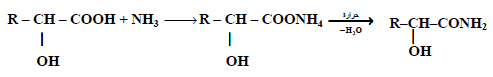
(4) التفاعل مع أحماض عضوية:
تتفاعل الأحماض الهيدروكسلية مع الأحماض العضوية مثل حمض الخليك أو كلوريد أسيتيل أو انهيدريد الخليك لتعطي أسترات:
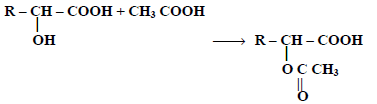
(5) التفاعل مع حمض الهيدروكلوريك
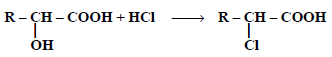
(6)التفاعل مع الصوديوم
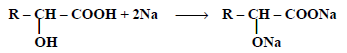
(7) أكسدة الأحماض الهيدروكسيلية:
تتأكسد الأحماض الهيدروكسيلية إما إلى الدهيدات أو كيتونات :
المراجع : – أساسيات الكيمياء العضوية. محمد مجدي واصل ، جامعة الأزهر – جمهورية مصر العربية