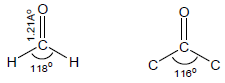الخواص الفيزيائية للألدهيدات والكيتونات
محتويات الموضوع
الخواص الفيزيائية للألدهيدات والكيتونات
– تتميز الألدهيدات والكيتونات بوجود مجموعة الكربونيل في جزئياتها فهي مركبات واسعة الانتشار في الطبيعة حيث توجد في الكربوهيدرات وبعض الهرمونات وفي غدد بعض الحيوانات لذلك كان من المهم جداً أن ندرس الخواص الفيزيائية للألدهيدات والكيتونات.
تعريف الألدهيدات والكيتونات
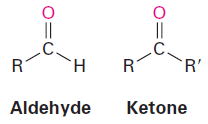
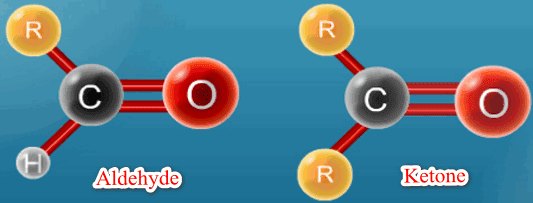
الألدهيدات Aldehydes
– تتصل فيها مجموعة الكربونيل بذرة هيدروجين واحدة على الأقل ويطلق عليها اسم مجموعة الفورميل formyl وتكتب –CHO
الكيتونات Ketones
– تتصل فيها مجموعة الكربونيل بذرتي كربون وتعرف بمجموعة الكيتون –C=O
أهمية مجموعة الكربونيل في الألدهيدات والكيتونات
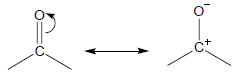
– مجموعة الكربونيل Carbonyl group هي مجموعة غير مشبعة تتكون من ذرة أكسجين مرتبطة برابطة زوجية مع ذرة كربون.
– علاوة على ذلك تعتبر من أهم المجموعات العضوية فهي توجد في جزيئات الأحماض الكربوكسيلية ومشتقاتها.
بناء مجموعة الكربونيل
– إن تهجين ذرة الكربون في مجموعة الكربونيل من نوع sp2 وبالتالي هي والذرات الثلاثة المرتبطة بها في مستوى واحد والشكل الفراغي هو مثلث مسطح Planar triangle كما يلي:
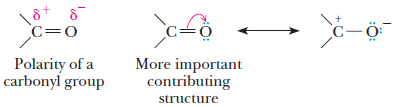
– أن مجموعة الكربونيل تجمع بين خاصيتى عدم التشبع والقطبية فهي مجموعة مستقطبة بسبب ارتفاع كهروسالبية ذرة الأكسجين والتأثير الرنينى لها كما بالشكل التالي:
(1) درجة غليان الألدهيدات والكيتونات
Boiling point of Aldehydes and Ketones
– أن قطبية مجموعة الكربونيل تجعل الألدهيدات والكيتونات مركبات عالية القطبية.
– وهذه الخاصية تعمل على إنشاء قوى تجاذب بين الجزيئات أو ما يطلق عليه تجاذب بين الشحنة الجزئية السالبة على أكسجين مجموعة الكربونيل لجزيء والشحنة الجزئية الموجبة على كربون مجموعة الكربونيل لجزيء آخر كما بالشكل التالي:
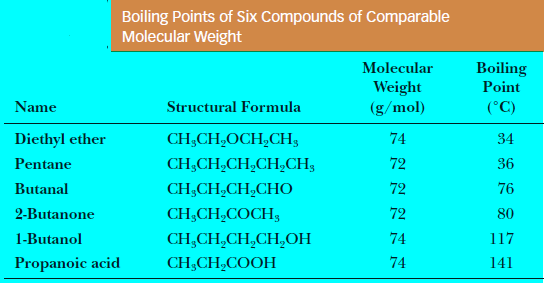
– وبسبب هذه القطبية يكون لها درجات غليان أعلى من درجات غليان الهيدروكربونات والإيثرات المقابلة لها في الوزن الجزيئي.
– ولكنها أقل من درجات غليان الكحولات المقابلة لها في الوزن الجزيئي نظراً لعدم مقدرتها على تكوين روابط هيدروجينية بين جزيئاتها.
– الجدول التالي يوضح درجات الغليان للألدهيدات والكيتونات حسب الوزن الجزيئي كما يلي:
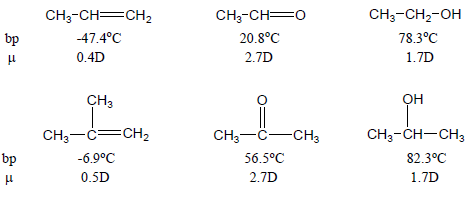
– الأمثلة التالية توضح قوة الروابط الهيدروجينية بالنسبة لقوة التجاذب القطبي من خلال قيم العزم القطبي لجزيئات مختلفة متقاربة في الوزن الجزيئي كما يلي:
(2) ذوبانية الألدهيدات والكيتونات
Solubility of Aldehydes and Ketones
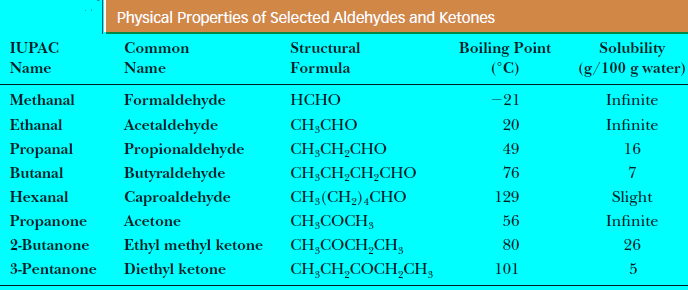
– تذوب الألدهيدات والكيتونات منخفضة الوزن الجزيئي في الماء بدرجة عالية وذلك لمقدرتها على تكوين روابط هيدروجينية مع ذرة الهيدروجين في جزئ الماء.
– كما تقل الذوبانية بزيادة الوزن الجزيئي وطول السلسلة الهيدروكربونية لجزيء الألدهيد أو الكيتون.
– الجدول التالي يوضح ذوبانية الألدهيدات والكيتونات كما يلي:
– كما تذوب الألدهيدات والكيتونات في المذيبات العضوية مثل البنزين والأثير وغير ذلك.
(3) الحالة الفيزيائية للألدهيدات والكيتونات
Physical State of Aldehydes and Ketones
– جميع الألدهيدات والكيتونات سوائل عند درجة حرارة الغرفة ماعدا الفورمالدهيد فهو غاز عديم اللون.
تمارين محلولة على الخواص الفيزيائية للألدهيدات والكيتونات
تمرين (1): اختر المركب الأعلى في درجة الغليان من الأزواج الأتية كما يلي:
(a) Pentanal, 1-Pentanol
(b) n-Pentane, Pentanal
(c) Acetophenone, 2-Phenyl ethanol
الحل:
ستكون الإجابة عن السؤال كما يلي:
1-Pentanol (a)لمقدرته على تكوين روابط هيدروجينية بين جزيئاته.
Pentanal (b) بسبب قطبية الجزئ.
(c) 2-Phenyl ethanol
تمرين (2): في السؤال السابق أي المركبين في المجموعة له ذوبانية أعلى في الماء ولماذا؟
الحل:
ستكون الإجابة عن السؤال كما يلي:
1-Pentanol (a) لمقدرته على تكوين روابط هيدروجينية مع الماء لأكونها قوى من التي يكونها Pentanal
Pentanal (b) يكون رابطة هيدروجينية مع الماء.
(c) Acetophenone لأن حجم المجموعة الهيدروكربونية أصغر.
المراجع :
- أسس الكيمياء العضوية . وائل غالب محمد – وليد محمد السعيطي ، الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا
- أساسيات الكيمياء العضوية. محمد مجدي واصل ، جامعة الأزهر – جمهورية مصر العربية
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States