تفاعلات الفينول Reactions of phenol
محتويات الموضوع
تفاعلات الفينول Reactions of phenols
– تنقسم تفاعلات الفينول إلى قسمين رئيسيين كما يلي:
- تفاعلات تتم على مجموعة الهيدروكسيل
- تفاعلات إحلال إلكتروفيلي تتم على حلقة البنزين
أولاً/ تفاعلات الفينول التي تتم على مجموعة الهيدروكسيل
(1) حامضية الفينول Acidity of Phenol
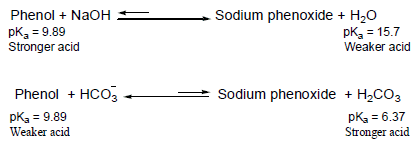
– تعتبر الفينولات أحماض ضعيفة ولكنها أعلى حمضية من الكحولات.
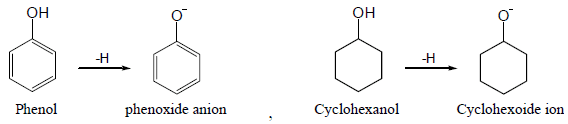
– المثال التالي يقارن بين الفينول والسايكلوهكسانول من حيث الخاصية الحمضية كما يلي:
– يفسر ارتفاع حمضية الفينولات عن الكحولات على أساس الرنين في حلقة الفينيل الذي يؤدي إلى سحب الإلكترونات على ذرة الأكسجين في مجموعة الهيدروكسيل فيقل تركيز الشحنة السالبة الجزئية عليها فيساعد ذلك على خروج البروتون من جزئ الفينول ويصبح أيون الفينوكسيد مثبت بالرنين أكثر من جزئ الفينول.
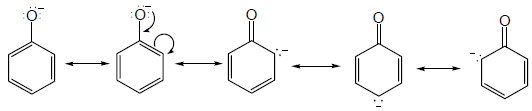
– إن تفاعل تأين الفينول أقل امتصاصاً للحرارة من تأين الهكسانول الحلقي لذلك فأن التفاعل سيكون في أتجاه تكوين الفينوكسيد كما يلي:
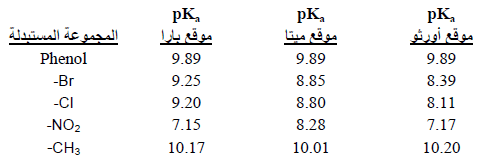
– تزداد حامضية ايون الفينوكسيد بوجود مجاميع ساحبة للألكترونات Electron-withdrawing [EWG] حيث تزيد من ثباته وتقلل المجاميع الدافعة للألكترونات Electron-donating [EDG] من ثبات أيون الفينوكسيد وبالتالي تقلل من حمضيته.
– والجدول التالي يوضح ذلك من خلال قيم pKa كما يلي:
تمرين محلول: رتب المركبات التالية في كل مجموعة حسب الزيادة في الحمضية؟
a – Phenol , p-Methyl phenol , p-(Trifluoro methyl) phenol
b – Benzyl alcohol , Phenol
c – p-Bromo phenol , 2,4-Dibromo phenol , 2,4,6-Tri bromo phenol
الإجابة:
ستكون الإجابة كما يلي:
a – p-Methyl phenol < phenol < p-(Trifluoro methyl) phenol
b – Benzyl alcohol < phenol
c – p-Bromo phenol < 2,4-DiBromo phenol < 2,4,6-Tribromo phenol
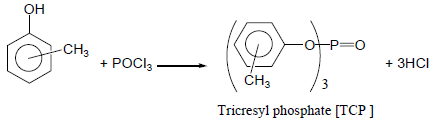
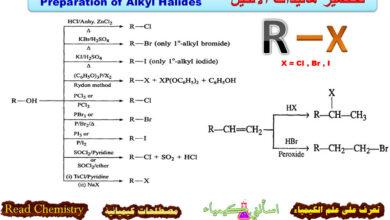
(2) تفاعلات الفينول مع Phosphorus oxychloride POCl3
– تتفاعل متشكلات الكريسول ( أورثوا – بارا – ميتا) مع POCl3 وينتج TCP الذي يضاف لوقود الجازولين لزيادة جودته كما بالمعادلة الآتية:
(3) تفاعلات الفينول مع كلوريد الحديديك Iron (III) chloride
– يستخدم هذا التفاعل للكشف عن الفينولات لأنها تعطي محاليل ذات ألواناً مميزة لكل مركب حيث يعطى الفينول لون بنفسجي ويعطي Cresol لون أزرق بينما Catechol يعطي لوناً أخضر.
– وكذلك يمكن استخدامه في تميزها عن الكحولات حيث تتفاعل مع كلوريد الحديديك وتعطي محاليل غير ملونة كما بالتفاعل التالي:
تمرين محلول: كيف تميز باختبارين كيميائيين بين كل من:
p-Cresol and Benzyl alcohol
الحل:
– يمكن استخدام التفاعل مع كلوريد الحديديك فينتج محلول أزرق اللون مع الكريسول ومحلول غير ملون مع بنزيل الكحول.
– عند استخدام هيدروكسيد الصوديوم يتفاعل الفينول ولا يتفاعل الكحول
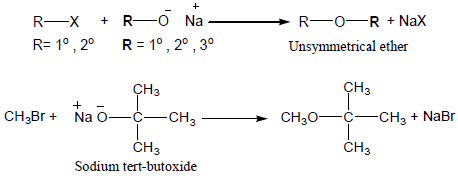
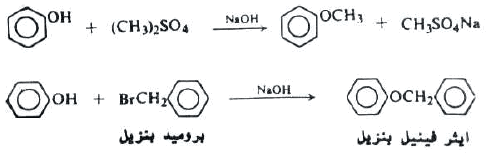
(4) تفاعل تكوين الأيثرات (Williamson synthesis)
– نسبة للعالم الأنجليزي Alexander.W.Williamson حيث يعتبر من أهم الطرق لتحضير الإيثرات المختلفة وذلك بتفاعل هاليد الألكيل مع Sodium alkoxide أو Sodium phenoxide.
– عملياً يمكن إجراء تفاعل ويليامسون لتحضير الايثرات من الفينولات وذلك من خلال مفاعلة هاليد الألكيل مع فينوكسيد الصوديوم.
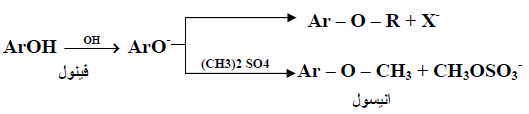
– أما بالنسبة لتحضير ايثرات الميثيل للفينولات فإنه يمكن استخدام كبريتات ثنائي ميثيل بدلاً عن هاليدات الميثيل الغالية نسبياً [[(CH3)2 SO4 وكما موضح بالمعادلة التالية:
– يسمى تفاعل تحضير الايثرات باستخدام هاليدات الألكيل مع أنيونات الفينولات أو الكحولات بتفاعل ويليامسون .
– في هذا التفاعل سيعمل أيون الفينوكسيد كعامل نيوكليو فيلي ويهاجم هاليد الألكيل أو الكبريتات ليزيح أيون الهاليد أو أيون الكبريتات وكما يتضح من التفاعلين التاليين:
(5) تفاعل تكوين الأسترات
– من المعلوم أن الفينولات يمكن تحويلها إلى أسترات من خلال تفاعلها مع الأحماض الكاربوكسيلية أو مشتقاتها ، كلوريد الحامض أو الأنهيدريدات>
– ومن المفروض أن يكون الطالب قد تعرف على هذه التفاعلات عند دراسة الأحماض الكاربوكسيلية .
– وفيما يلي بعض الأمثلة لهذه التفاعلات:
– ولابد أن نتذكر أن كلوريدات الأحماض الأروماتية ArCOCl أقل فعالية من كلوريدات الأحماض الأليفاتية RCOCl
– وعلي هذا الأساس ، فإنه لتحويل الفينولات إلى أسترات من خلال التفاعل مع كلوريدات الأحماض الأروماتية يجب إجراء التفاعل حسب طريقة Schotten – Baumann شوتن – باومان.
– تتضمن هذه الطريقة إضافة كلوريد الحامض على شكل دفعات مع إجراء التحريك الشديد أثناء الإضافة على محلول المركب الهيدروكسيلي المذاب بقاعدة ، ويستخدم لهذا الغرض ، محلول هيدروكسيد الصوديوم المائي أو البيريدين .
– كما يعتقد أن القاعدة المستخدمة هي ليست لمعادلة الحامض المتحرر فحسب بل لتنشيط التفاعل أيضاً.
ثانياً/ تفاعلات الفينول – تفاعلات الإحلال الإلكتروفيلي
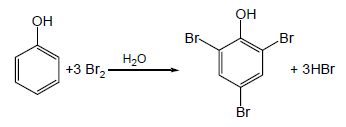
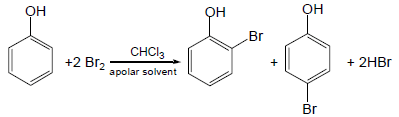
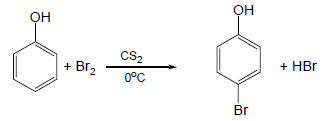
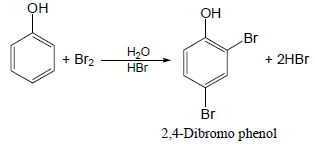
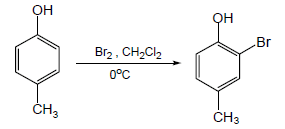
(1) هلجنة الفينول Halogenation of phenols
– وللحصول على ناتج أحادي الاستبدال يتم التفاعل في وجود رباعي كلورو ميثان أو ثاني كبريتيد الكربون Carbon disulfide CS2 عند درجات حرارة منخفضة فيكون الناتج الرئيسي هو متشكل بارا بمردود 82% تقريباً.
– وللحصول على ناتج واحد ثنائي الاستبدال يستخدم محلول مائي لحمض قوي فيتوقف التفاعل عند الاستبدال الثاني بمردود 87% تقريباً كما بالمعادلة الآتية:
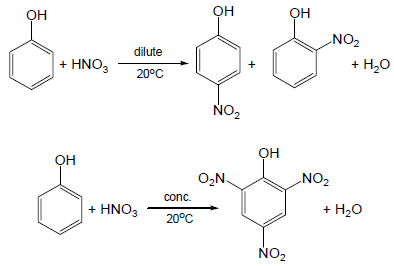
(2) نيترة الفينول Nitration of phenols
– بالإضافة إلى ذلك يتفاعل الفينول مع حمض النيتريك Nitric acid المخفف عند درجات حرارة منخفضة ويعطي خليط من متشكل أورثوا وبارا، ويتفاعل مع الحمض المركز وينتج حمض البكريك Picric acid
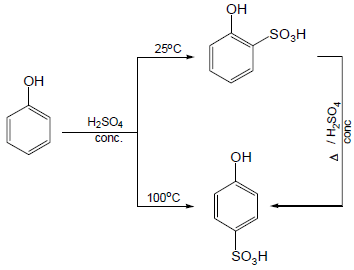
(3) سلفنة الفينول Sulfonation of phenols
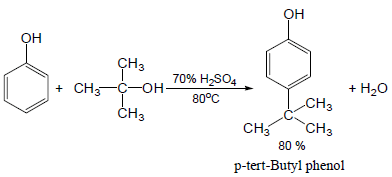
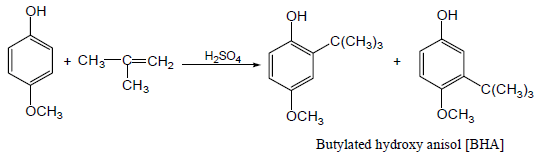
(4) إلكلة فريدل كرافت للفينول Friedel-Crafts alkylation
– علاوة على ذلك يستخدم تفاعل فريدل كرافت في تحضير كل من BHT ، BHA التي تستخدم في حفظ الأطعمة ومنع تأكسدها.
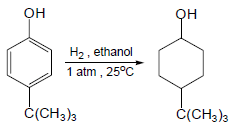
(5) تفاعل الهدرجة للفينول
Catalytic hydrogenation of aromatic ring
– يتم هدرجة الحلقة الأروماتية عن طريق استخدام rhodium مع الكربون كحفاز في وجود غاز الهيدروجين كما بالمعادلة الآتية:
المراجع:
-
أسس الكيمياء العضوية . وائل غالب محمد – وليد محمد السعيطي ، الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا
- أساسيات الكيمياء العضوية. محمد مجدي واصل ، جامعة الأزهر – جمهورية مصر العربية
إقرا إيضاً عبر موقعنا الموضوعات المتعلقة بالفينول كما يلي:
(1) التسمية والخواص الفيزيائية للفينولات
(2) تجربة تحضير الفينول فى العمل Preparation of Phenol
(3) طرق تحضير الفينول وبعض مشتقاته Preparation of Phenol and its derivatives


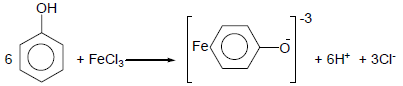
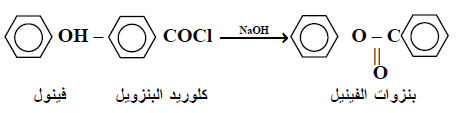
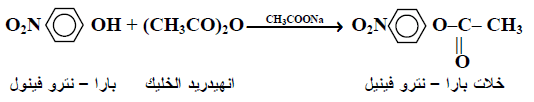
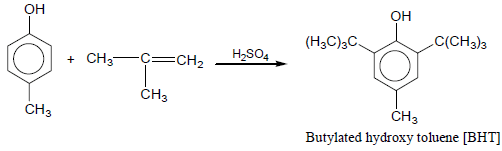


سلام عليكم ممكن ملف pdf