تفاعلات الكحولات – الخواص الكيميائية للكحولات
تفاعلات الكحولات
– تنقسم تفاعلات الكحولات كما يلي:
(1) تفاعلات تنكسر فيها الرابطة أكسجين هيدروجين (O-H)
(2) تفاعلات تنكسر فيها الرابطة كربون – أكسجين (C-O)
محتويات الموضوع
أولاً/ تفاعلات الكحولات التي تتكسر فيها الرابطة RO-H
– تعتمد هذه التفاعلات على حمضية الكحولات حيث تنكسر الرابطة بين ذرة الأكسجين وذرة الهيدروجين فمجموعة الهيدروكسيل عند تفاعلها مع الفلزات النشطة والأحماض العضوية بسبب استقطاب هذه الرابطة.
– تفاعلات الكحولات التي تتكسر فيها الرابطة RO-H كما يلي:
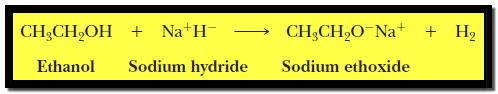
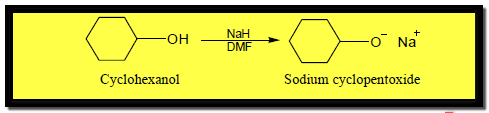
(1) التفاعل مع الفلزات القلوية Reaction of alcohols with alkali metals
(2) تفاعل تكوين الأسترات Ester formation
(3) تفاعل الأكسدة Oxidation of alcohols
(4) إضافة الكحول للألكين Addition of alkene to alcohol
(5) التفاعل مع الفوسجين Reaction of alcohols with Phosgene
(1) التفاعل مع الفلزات القلوية Reaction with alkali metals
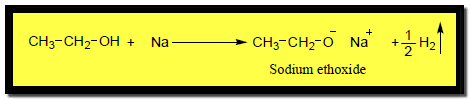
– تتفاعل الكحولات كحوامض مع الفلزات القلوية مثل Li , Na , K حيث تحل ذرة الفلز محل ذرة الهيدروجين في مجموعة الهيدروكسيل.
– ويوضح التفاعل السابق أن الكحولات أحماض ضعيفة ويعود ذلك إلى قطبية رابطة أكسجين – هيدروجين التي تسمح بانطلاق ذرة الهيدروجين بصيغة بروتون .
– الكحولات أضعف حامضياً من الماء.
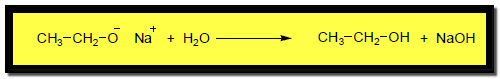
– والسبب أن لمجموعات الألكيل في الكحولات تأثير حثي موجب فهي تطلق الكترونات في اتجاه ذرة الأكسجين لتزيد من سالبيتها الكهربية وبالتالي تقلل من سهولة انطلاق البروتون من مجموعة الهيدروكسيل، ونتيجة لذلك يكون تفاعل فلز الصوديوم نشطاً أكثر في حالة الكحولات الأولية ، ونتيجة التأثير الحثي فإن الكحولات لا تتفاعل مع هيدروكسيد الصوديوم أو البوتاسيوم المائي .
– ويتفاعل الكحول مع Sodium hydride ويعطي نفس الناتج حيث أن Hydride ion H– قاعدة قوية جداً.
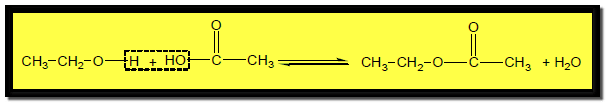
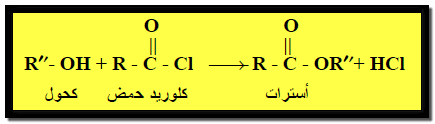
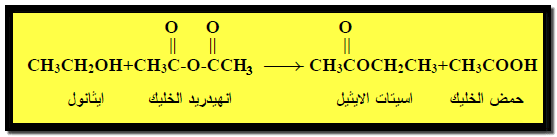
(2) تفاعل تكوين الأسترات Ester formation
– تتفاعل الكحولات مع الأحماض الكربوكسيلية أو مشتقاتها (كلوريدات الأحماض او الأنهيدريدات) وتكون الإسترات والماء.
– ويتم هذا التفاعل في وجود حمض الكبريتيك المركز في وجود حمض الكبريتيك المركز ليعمل على نزع الماء ومنع حدوث التفاعل العكسي.
(3) تفاعل أكسدة الكحولات Oxidation of alcohols
هي تفاعلات تتم على مجموعة الكربينول ويتوقف الناتج على نوع الكحول كما يلي:
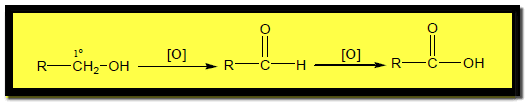
أكسدة الكحولات الأولية Oxidation of Primary alcohols
– تتأكسد الكحولات الأولية على خطوتين حيث تعطي ألدهيدات أولاً ثم تتأكسد إلى أحماض كربوكسيلية.
– للحصول على الألدهيد يتم إزالته من التفاعل حتى لا يتأكسد إلى حمض كربوكسيلي وذلك اعتماداً على الفارق في درجة الغليان ولكن هذه الطريقة لا تعطي مردوداً عال من الألدهيد لذلك تحضر صناعياً باستخدام فلز النحاس مع التسخين لإزالة الهيدروجين.
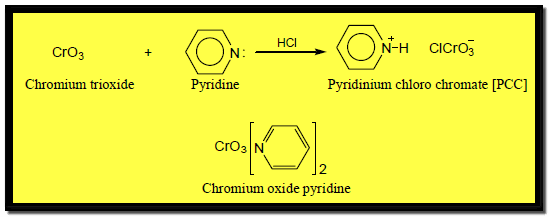
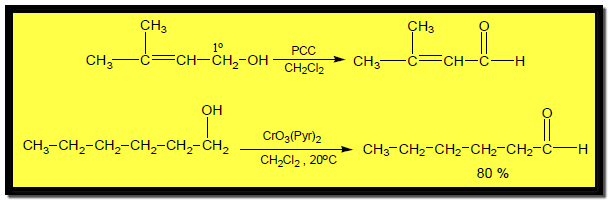
– معملياً يستخدم معقد Pyridine-Chromic مثل كاشف كوللنز Collins’s reagent وكذلك PCC الذي يعرف بكاشف كوري Corey’s reagent
– حيث تؤكسد هذه المعقدات الكحولات الأولية إلى ألدهيدات ويتوقف التفاعل عند هذا الحد ولا تؤثر هذه المعقدات على الروابط الزوجية إن وجدت في جزئ الكحول.
– عند استخدام العوامل المؤكسدة مثلKMnO4 , Na2Cr2O7 أو كاشف Jones’s reagent وهو عبارة عن CrO3 في محلول مائي لحمض الكبريتيك تنتج أحماض كربوكسيلية كما فى المعادلات الآتية:
أكسدة الكحولات الثانوية Oxidation of secondary alcohols
– تتأكسد على خطوة واحدة وتعطي كيتون كما فى المعادلات الآتية:
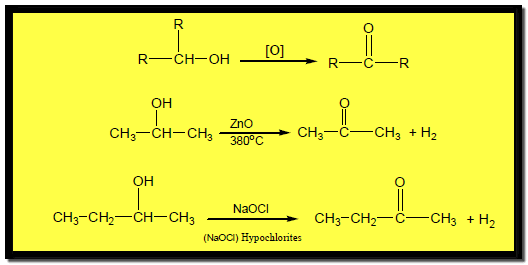
أكسدة الكحولات الثالثية Oxidation of tertiary alcohols
– لا تتأكسد تحت الظروف العادية لأن أكسدتها تتطلب كسر رابطة C-C
– ويستخدم تفاعل التأكسد بكرومات البوتاسيوم للكشف عن نوعية الكحولات ، حيث يتحول لون المحلول من أحمر – برتقالي إلى اللون الأخضر في حالة الكحولات الأولية والثنائية فقط ، ولا يتغير في حالة الكحولات الثالثية .
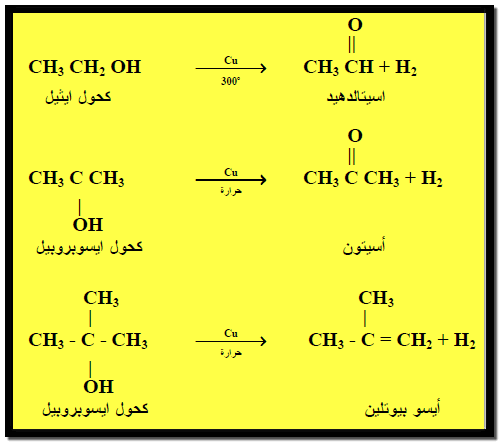
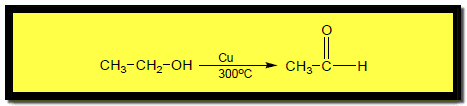
أكسدة الكحولات بالنحاس الساخن Oxidition of alcohols by hot Copper
– عند تمرير أبخرة الكحولات الأولية والثنائية والثالثية فوق النحاس الساخن 300 Co فإنها تفقد جزئي هيدروجين وتتحول إلى إلدهيدات وكيتونات والكينات على التوالي كما يلي:
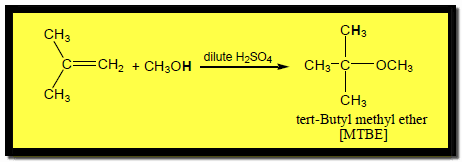
(4) إضافة الكحول للألكين Addition alkene to alcohols
– يضاف الكحول للألكين في وجود حمض الكبريتيك المخفف كما يلي:
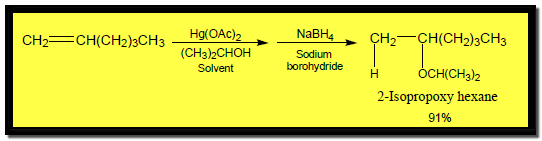
– ويضاف الكحول للألكين باستخدام أسيتات الزئبقيك Alkoxymercuration-reduction كما يلي:
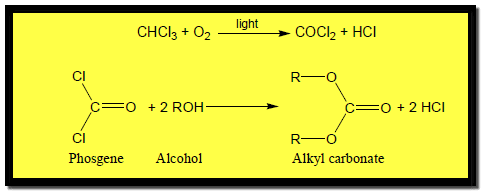
(5) تفاعلات الكحولات مع الفوسجين Reaction with Phosgene
– يستخدم هذا التفاعل تجارياً في تحضير كربونات الألكيل التي تستخدم كمذيبات عضوية كما بالمعادلات الآتية:
ثانياً /تفاعلات الكحولات التي تتكسر فيها الرابطة C- O
– تفاعلات الكحولات التي تتكسر فيها الرابطة C-Oكما يلي:
(1) تفاعل نزع الماء Dehydration of alcohols
(2) تفاعل الكحولات مع الأحماض المعدنية HX
(3) تفاعل الكحولات مع PBr3 – Phosphorous Tribromide
(4) تفاعل الكحولات مع SOCl2 – Thionyl Chloride and Thionyl Bromide
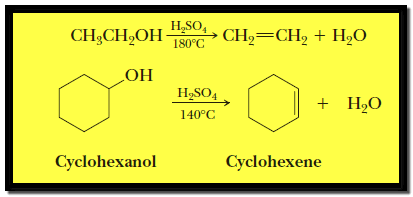
(1) تفاعل نزع الماء Dehydration of alcohols
تكوين الألكين Alkene formation
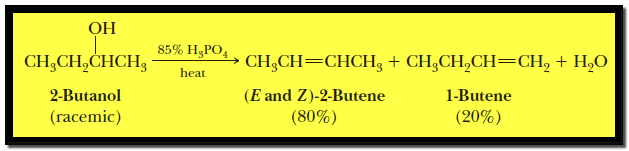
– عند نزع الماء من الكحول يكون الألكين الأكثر استبدالاً هو الناتج الرئيسي وتكون فعالية الكحولات تجاه نزع الماء كما يلي:
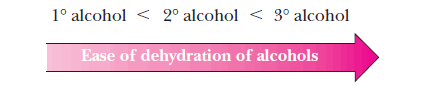
– بينما فى حالة إضافة حمض الفسفوريك تركيز 85% إلى الكحولات خاصة من النوع racemic تنتج متشكلات من الألكينات (E , Z alkenes)
تكوين الإيثر Ether formation
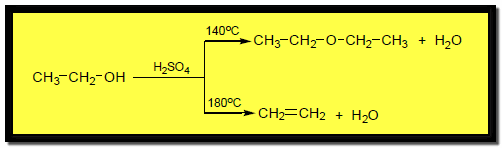
حيث ينزع حمض الكبريتيك جزي ماء من جزيئين من الكحول عند درجة حرارة 140 Co بينما ينزع جزئ ماء من جزئ واحد من الكحول عند درجة حرارة 180 Co
(2) تفاعلات الكحولات مع الأحماض المعدنية HX
علاوة على ذلك تتفاعل الكحولات مع هاليدات الهيدروجين لتعطي هاليدات ألكيل :
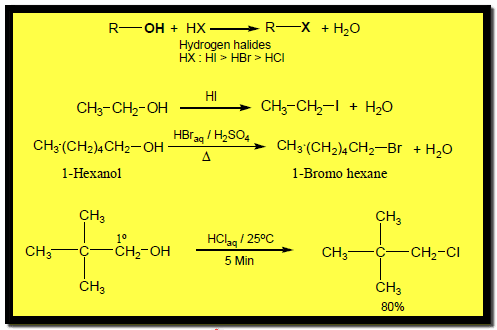
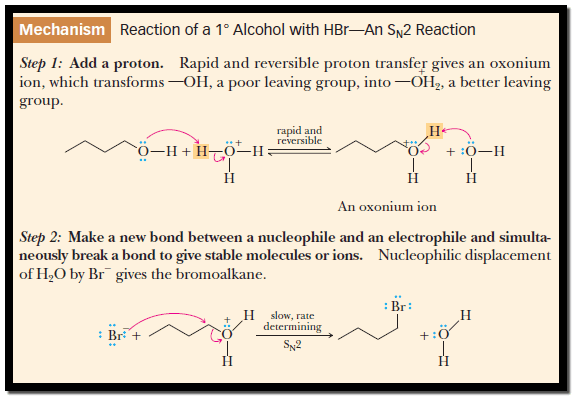
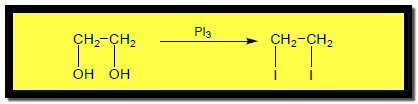
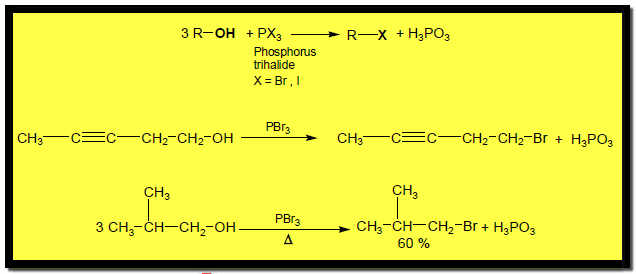
(3) تفاعلات الكحولات مع PBr3
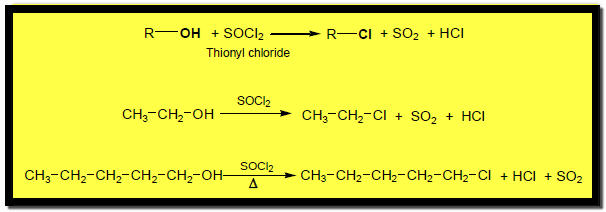
(4) تفاعلات الكحولات مع SOCl2
تتفاعل الكحولات مع Thionyl Chloride and Thionyl Bromide وتنتج هاليدات ألكيل نتيجة هذا التفاعل :
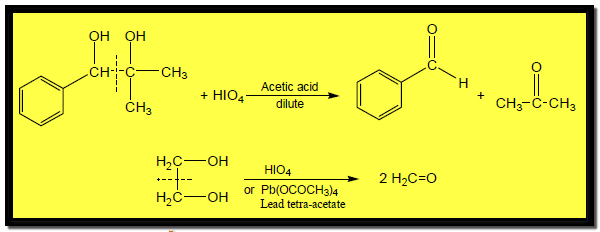
تفاعلات الجلايكولات Reaction of glycols
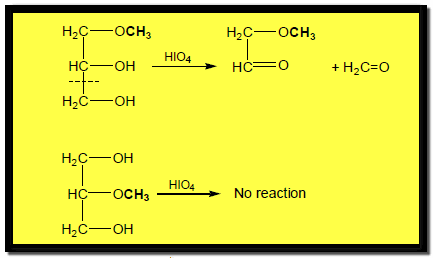
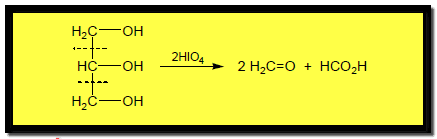
شطر الجلايكولات بالأكسدة Oxidative cleavage of Glycols
– يمكن للرابطة C -C بين مجموعتي الكربينول في الجلايكولات أن تنشطر عن طريق التفاعل مع Periodic acid أو رباعي أسيتات الرصاص لتعطي مركبات كربونيل كما بالمعادلات الآتية:
أختزال الجلايكولات Reduction of Glycols
تفاعلات الجليسرول Reaction of Glycerol
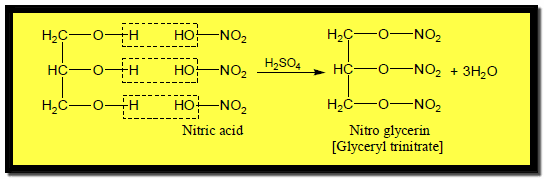
تفاعل الجليسرول مع الأحماض
– يتحول الجليسرول عند معالجته بحمض النيتريك والكبريتيك المركزين إلى نيترو جليسرين وهي مادة متفجرة تستخدم في صناعة الديناميت كما بالمعادلة الآتية:
شطر الجليسرول Cleavage of Glycerol
– يتفاعل الجليسرول بنفس الطريقة التي تتفاعل بها الجلايكولات حيث ينشطر إلى ألدهيد وحمض كربوكسيلي كما يلي:
– ويستخدم هذا التفاعل في التمييز بين متشكلات الجليسرول أحادية الاستبدال كما يلي:
- أسس الكيمياء العضوية . وائل غالب محمد – وليد محمد السعيطي ، الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا
- أساسيات الكيمياء العضوية. محمد مجدي واصل ، جامعة الأزهر – جمهورية مصر العربية
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United State






علل الاغوال لا تتفاعل مع هيدروكسيد الصوديوم