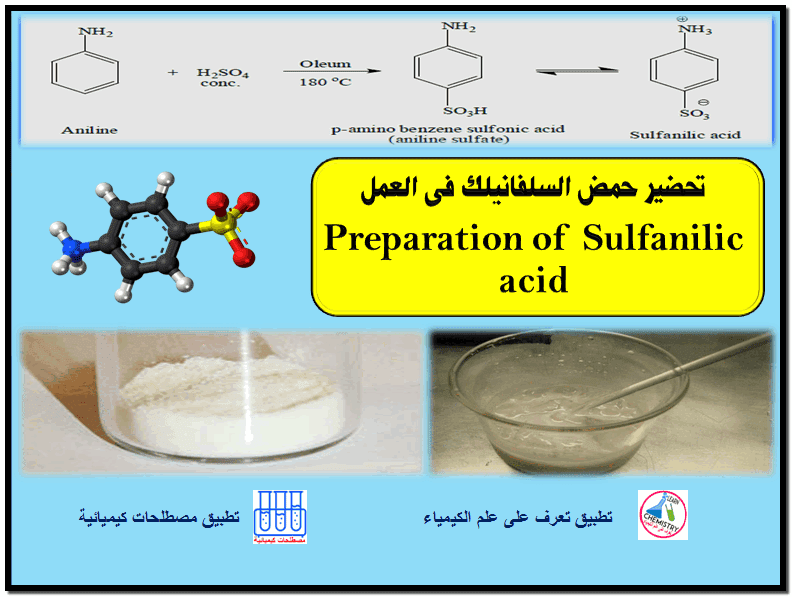
تأثير بنية المادة المتفاعلة على تفاعلات الاستبدال النيكليوفيلية SN1 , SN2
– ناقشنا في أحد الموضوعات السابقة تفاعلات الاستبدال النيكليوفيلية SN1 , SN2 . والآن سنتكلم عن العوامل المؤثرة على تفاعلات الاستبدال النيكليوفيلية. ونظراً لكثرة هذه العوامل سنشرح كل عامل من هذه العوامل في موضوع منفصل.
العوامل المؤثرة على تفاعلات الاستبدال النيكليوفيلية
(1) تأثير بنية المادة المتفاعلة Substrate Structure
(2) تأثير المجموعات المهاجمة Attacking Nucleophile
(3) تأثير المجموعة المغادرة leaving group
أضغط على أي عنصر مما سبق لقراءته.
– وفى هذا الموضوع سنناقش فقط تأثير بنية المادة المتفاعلة The Effect of Substrate Structure على تفاعلات الاستبدال النيكليوفيلية Nucleophilic Substitution reactions
تأثير بنية المادة المتفاعلة على تفاعلات الاستبدال النيكليوفيلية SN1 , SN2
تؤثر بنية المادة المتفاعلة تأثيراً واضحاً على ميكانيكية تفاعلات الاستبدال النيكليوفيلية بعدة طرق أهمها:
(1) التفرع على ذرتي الكربون الفا (α) وبيتا (β)
(2) عدم التشبع في وضع الفـا (α)
(3) عدم التشبع في الوضع بيتا (β)
(4) التعويض على الفـا (α)
(5) التعويض على بيتـا (β)
(6) تأثير المجاميع المعطية والساحبة للإلكترونات
(7) عندما تكون المادة المتفاعلة حلقية
(8) تأثير الجسور في المادة المتفاعلة Bridgeheads Substrate
(9) تأثير التعويض بنظير الهيدروجين Deuterium Substitution
أولاً/ التفرع على ذرتي الكربون الفا (α) وبيتا (β)
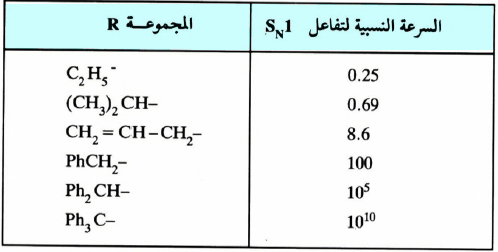
– تتأثر ميكانيكية تفاعلات SN2 تأثراً واضحاً نتيجة لزيادة عدد المجاميع المستبدلة على ذرتي الكربون الفا وبيتا. وتكون النتيجة نقصاناً واضحاً في سرعة التفاعل كلما زاد عددها.
– على سبيل المثال نجد أن المركبات الثالثية (Tertiary) ) من النادر أن تتفاعل بواسطة ميكانيكية تفاعلات الاستبدال النيكليوفيلية SN2 . وأوضح مثال على ذلك مركب نيوبنتايل ( (Neopentyl) إذ يتفاعل ببطء.
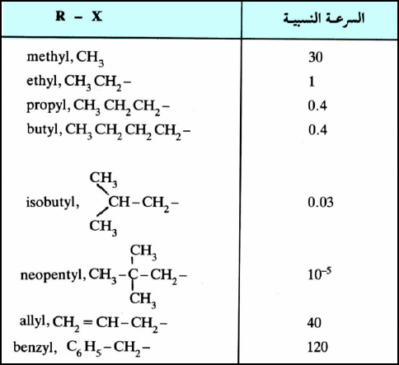
– ويتضح من الجدول التالي معدل السرعة النسبية لتفاعلات تفاعلات الاستبدال النيكليوفيلية SN2 لبعض هاليدات الألكيـل (R-X).
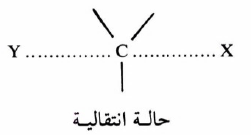
– ويتضح جلياً من الجدول السابق أن جميع هاليدات الألكيل فيه هاليدات أولية (o1) ، وأن نقصان معدل سرعة التفاعل فيها يرجع إلى تزاحم المجموعات الألكيلية على ذرة الكربون بيتا (β) ونخص بالذكر هنا مركب النيوبنتايل (Neopentyl) وتسمى هذه الظاهرة بالتزاحم الفراغي (Steric hindrance) حيث تظهر لنا الحالة الانتقالية أكثر تزاحماً (Crowded) عندما تكون المجموعات الألكيلية قريبة من ذرة الكربون المركزية.
– ويزيد التناقص كلما زاد عدد المجاميع المستبدلة على ذرة الكربون بيتا .حيث إنه من المعـروف لنـا في تفـاعـلات SN2 أن العامل النيكليوفيلي يهاجم من الجهة المعاكسة للمجموعة المغادرة (X) . ولكن المجاميع المستبدلة على ذرة الكربون تعيق تقدمه نحو ذرة الكربون المركزية.
– وكلما كبر حجم المجاميع المستبدلة كلما أعاقه التفاعل وذلك بسبب تزاحمها في الحالة الانتقالية.
– يتضح من الجدول السابق أيضا تعذر سلوك النيوبنتايل لميكانيكية SN2. إذ يسلك بدلاً من ذلك ميكانيكية SN2 عند توفر العوامل المناسبة من مذيب وغيره.
– وعلى النقيض من ذلك فإن هناك زيادة في معدل سرعة التفاعل لكل من هاليدات الأليل (allyl) والبنزيل ( Benzyl). وتفسر هذه الظاهـرة بأن العامل النيكليوفيلي على ذرة الكربون المركزية يتيح لذرة الكربون أن تستخدم المدار غير المهجن (p) للتداخل مدار المجموعة المهاجمة (مثل (–HO) ومدار المجموعة الخارجة (–Cl) كذلك مع مدار (π) المكون لمجموعة الفينيل (Phenyl) وعليه يكون الناتج أكثر استقرارا بالمقارنة مع مركب مشبع مثل كلوريد الإيثيل، والذي تقل سرعة تفاعله وفقا لميكانيكية SN2 بمقدار مائة مرة بالمقارنة مع كلوريد البنزيل.
– كذلك الحال مع مركبات الأليل حيث يكون أيون الكربونيوم أكثر ثباتا. وذلك بسبب الطنين الذي ينتج عن وجود الرابطة المزدوجة في وضع متبادل مع الشحنة الموجبة:
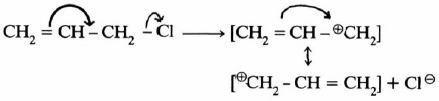
– وسوف نرى أن كلاً المركبين كلوريد البنزيل والأليل يفضلان SN1
تأثير وجود الرابطة المزدوجة على ذرة الكربون ألفا
– على العكس مما سبق ففي حالة وجود الرابطة الزوجية على ذرة الكربون الفا كما هو في حالة كلوريد الفاينايل CH2 = CH-Cl أو الكلوروبنزين. فإن هذه المركبات غير نشطة تماماً لتفاعلات الاستبدال، ويرجع السبب هنا إلى أن:
(1) ذرة الهالوجين مرتبطة تماماً إلى ذرة كربون sp2. وعليه تكون النتيجة أن زوج إلكترونات الرابط بين C – Cl يكون مسحوباً أكثر نحو ذرة الكربون خلافاً لما هو معروف في حالة الكربون sp3. وهذا يجعل تكون الرابطة بين الكربون والهالوجين قوية ويصعب كسرها بالمقارنة مع المركبات المشبعة مثل CH3CH2Cl.
(2) كذلك فإن الإلكترونات في الرابطة الزوجية تعمل على إعاقة اقتراب العامل النيكليوفيلي بسبب التنافر بين الإلكترونات.
(3) كذلك فإن الرابطة الزوجية تعمل على عدم ثبات كل من أيون الكربونيوم في حالة SN1 أو الحالة الانتقالية في تفاعلات SN2 وينطبق هذا التفسير على هاليدات البنزين.
ويختلف الحال في ميكانيكية تفاعلات SN1 إذ أن وجود المجموعة الألكيلية على ذرة الكربون الفا تعمل على زيادة سرعة التفاعل كما هو واضح من الجدول التالي:
– الجدول يوضح المعدل النسبي لسرعة تحلل RBr في مذيبين مختلفين:
ملاحظات على الجدول السابق
يتضح من الجدول السابق أن سرعة التفاعل تزداد بازدياد البدل على ذرة الكربون الفا. ويمكن تفسير ذلك بأن زيادة البدل تؤدي إلى زيادة درجة ثبات أيون الكربونيوم الناتج بعد خروج البروم في حالة تكون الحالة الوسطية. ودرجة ثبات أيون الكربونيوم تكون كالتالي:
tertiary > secondary > primary
1° > 2⁰ > 3⁰
وفي الحقيقة فإن سرعة التفاعل لا تعتمد على درجة ثبات أيون الكربونيوم بل على الفرق في الطاقة الحرة (Free energy) بين المادة المتفاعلة والحالة الانتقالية التي تؤدي إلى تكون أيون الكربونيوم كحالة وسطية والذي يزداد ثباته بزيادة المجموعات الألكيلية على ذرة الكربون الفا، مما يؤدي إلى نقصان الطاقة الحرة لأيون الكربونيوم في الحالة الانتقالية (T.S)
– كما يبين الجدول السابق أن هناك فرقاً كبيراً بين سرعة التفاعل للهاليدات الثالثية مقارنة مع الهاليدات الأخرى. وهذا دليل قاطع على أن:
- الهاليدات الثالثية تسلك في تفاعلاتها ميكانيكية SN1
- أما بالنسبة إلى الهاليدات الأولية فإنها تسلك في تفاعلاتها ميكانيكية SN2
- وفي المقابل فإن هاليدات الألكيل الثانوية تسلك أياً من الميكانيكيتين SN1 , SN2 حسب تأثير المجاميع البديلة.
– وفي الحقيقة فإن سرعة التفاعلات لا تعتمد على درجة ثبات أيون الكربونيوم بل على الفرق في الطاقة الحرة بين المادة المتفاعلة والحالة الانتقالية.
ثانياً/ عدم التشبع في وضع الفـا (α)
– تتأثر ميكانيكية تفاعل الاستبدال بكون المادة المتفاعلة غير مشبعة مثل هاليدات الفاينايل والأسيتيلين ومشتقات البنزين. وقد سبق وأشرنا إلى ذلك في الفقرة السابقة.
– وقد دلت النتائج على أن كون المادة المتفاعلة غير مشبعة يؤدي إلى إبطاء تفاعلات الاستبدال أو توقفها، ويرجع ذلك إلى عدة أسباب:
(1) أن ذرة الكربون sp2 أو كربون sp تكون أكثر كهروسالبية من ذرة الكربون sp3 مما يجعل الزوج الإلكتروني الرابط C – x أقرب إلى ذرة الكربون في حالة وجود sp , sp2
(2) أن البروتون في حالـة sp3-H يكـون أسهـل انفصالاً عنه في حالة sp3 بينما يكون البروتون في حالة sp2-H وسطاً بين الحالتين السابقتين. وعند انفصال البروتون يبقى زوج الإلكترونات على ذرة الكربون لكن تفاعلات الاستبدال تتطلب أن المجموعة المغادرة تحمل زوج الإلكترونات معهـا مما يفسر عدم نشاط المجاميع المشبعة على ذرة الكربون الفا في تفاعلات الاستبدال. وهناك أسباب أخرى تتعلق بقوة الرابطة بين C – X وبمعنى آخر طول الرابطة بين C – X ، فكلما كانت قصيرة كلما كانت أقوى.
– فقد وجد أن طول الرابطة بين ذرة كربون الفاينايل أو الأريل وذرة الكلور C – C1 يساوي 1.73Ao. مقارنة الحالة المشبعة C – Cl والتي تكون 1.78Ao. ويرجع السبب هنا إلى أن طول الرابطة ينقص كلما زادت مساهمة مدار (s) فيها.
– وجميع الأسباب السابقة متعلقة بدرجة ثبات المادة المتفاعلة. فقد وجد أن الأيون الموجب على ذرة الكربون غير المشبعة أكثر ثباتا من أيون الكربونيوم الأولى ولكنه أقل ثباتا من أيون الكربونيوم الثانوي كما تبين العلاقة التالية:
RCH2+ < RC+ = CH2 < RC+ H CH3
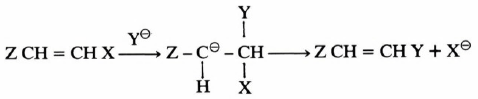
– ولقـد وجـد أن قلة ثبات أيون الفاينايل الموجب مقارنة مع أيون الكربونيوم الثانوي ليست هي وحدها المسؤولة عن نقصان سرعة تفاعلات SN1 وعلى أية حال فإنه يمكن زيادة سرعـة تـفـاعـلات مركبـات الـفـايـنـايل بإدخال مجموعات ساحبة للإلكترونات (Z) على الرابطة المضاعفة على ذرة الكربون β (مثل ZCH = CH X) حيث (Z) تمثل أحد المجاميع التالية:
الـخ Z = HCO, RCO, EtOOC, ArSO, NC, F
وتقوم هذه المجاميع بتثبيت أيون الكربون السالب المتكون (Carbanion) کما في المعادلة التالية:
– ويستثنى من ذلك وجود مجموعة الأريل على ذرة الكربون الفا. حيث إن ذلك يؤدي إلى تثبيت أيون الفاينايل الموجب الناتج. وغالباً ما يكون الناتج لصالحSN1
– كذلك فإن وجـود مجمـوعـة الـبـروبـايل الحلقي والفاينايل أو مجموعة تحمل رابطة زوجية مباشرة للفاينايل مثل ( RC = C = CX R) فإن جميعها تعمل على ثبات أيون الفاينايل المتكون ويكون التفـاعـل لـصـالح تفاعلات SN1 كما أن وجود مجاميع سهلة المغادرة مثل (triflate, OSO2CF3) تسهل من تفاعلات SN1
ويختلف الحال في هاليدات الأحماض إذ أن المركب أكثر نشاطاً منه في هاليدات الألكيل. ويرجع السبب إلى أن:
(1) مجموعة الكربونيل مجموعة مستقطبة تحمل فيها ذرة الكـربـون شحنة جزئية موجبة. مما يجعلها سهلة التفاعل مع العوامل النيكليوفيلية وهجـوم العامل النيكليوفيلي على ذرة الكربون حالة sp2. کما في مجموعة الكربونيل أسهل من هجومه على ذرة الكربون كما في هاليدات الألكيل المشبعة.
(2) الإضافة على الرابطة باي (π) في مجموعة الكربونيل يكون أسهل من كسر رابطة سيجما (σ) في هاليدات الألكيل المشبعة.
ثالثاً/ عدم التشبع في الوضع بيتا (β)
– إن سرعة تفاعلات SN1 عامة تزداد عند وجود رابطة مضاعفة على ذرة الكربون بيتـا وعليه كما سبق وأوضحنـا أن مركبات الأليل ومركبات البنزيل تتفاعل بسرعة ويتضح ذلك من الجدول التالي:
– الجدول يوضح السرعة النسبية لتفاعل ROTS مع الإيثانول (SN1)
ويرجع السبب إلى أن أيون الكربونيوم المتكون يكون أكثر ثباتا بواسطة الطنين (الرنين):
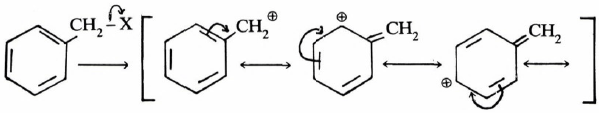
وهذا على العكس تماماً من وجود المجموعة غير المشبعة على ذرة الكربون الفا. حيث يعمل الطنين على ثبات الجزيء وليس الأيون. ولكن في حالة الاستبدال في وضع بيتا فإن الطنين يعمل على ثبات الأيون وليس الجزيء، حيث تكون هنا المجموعة X المغادرة والمجموعة غير المشبعة بعيدتين عن بعضها حتى لا يحدث طنين بينها.
– يتضح أيضاً من الجدول السابق أن التعويض بمجموعتين أو ثلاث مجاميع Phenyl تزيد من سرعة التفاعل كثيراً. ويعزى ذلك لثبات أيون الكربونيوم الناتج.
– وبصفة عامة فإن تفاعلات الاستبدال النيكليوفيلية SN1 في (الأليل) تزداد بزيادة الاستبدال بمجاميع الكيلية، أريلية أو هالوجينية على موضع 1 أو 3. حيث تقوم هذه المجاميع بتثبيت أيون الكربونيوم الناتج بواسطة الطنين المسمى (Hyperconjugation). وينطبق هذا القول على تفاعلات مركبات الأليل والبنزيل.
– ووجود الرابطة الثلاثية في موضع بيتا يؤدي إلى نفس النتائج التي يؤديها وجود الرابطة المضاعفة في هذا الموضع .
– أما في تفاعلات SN2 فإن وجود المجاميع المستبدلة مثل الألكيل والأريل والهاليد والسيانيد على موضع 3 في مركبات الأليل تعمل على زيادة سرعتهـا وذلك يرجع لثبات الحالة الوسطية. وفي المقابل فإن الاستبدال على موضع 1 يقلل من سرعة التفاعل نتيجة التزاحم الفراغي .
رابعاً/ التعويض على الفـا (α)
– تسلك المركبات التي لها الصيغة العامة YCH2X تفاعلات SN1 بسرعة حيث:
Y = RS–, R2N: , –OR
ويرجع السبب إلى زيادة الطنين لأيون الكربونيوم بسبب وجود مجموعة Y هذه حيث تحمل Y زوجاً إلكترونياً متصلاً مباشرة إلى ذرة الكربون الموجبة. وهذا بالتالي يعمل على ثبات أيون الكربونيوم ، ويمكن فصله بإضافة –SbF6
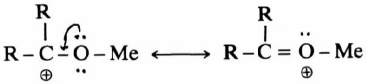
– أما في المركبـات مثل YCH2X حيث:
Y = NC , HCO, ROCO, NH2CO , RCO
فإن تفاعلات SN1 تتناقص مقارنة مع CH3X
ويعزى ذلك إلى أن المجموعات السابقة لها القدرة على سحب الإلكترونات. كما أن وجود مجموعة كربونيل أو مجموعة سيانيد في الموضع الفا تعمل بدرجة كبيرة على عدم ثبات أيون الكربونيوم المتكون لوجود شحنة جزئية موجبة صغيرة على ذرة الكربون المجاورة، كما هو واضح فيما يلي:
كما أن وجود مثل هذه المجموعات على ذرة الكربون الفا يزيد من سرعة تفاعلات SN2. ومثال على ذلك α-Chloroacetophenone حيث يتفاعل مع يوديد البوتاسيوم في محلول الأسيتون عند درجة 75مo فيكون التفاعل أسرع بمقدار 3200 مرة من n-butylchloride
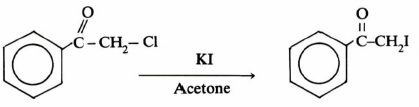
وهناك اقتراحات عديدة تفسر هذه الزيادة في سرعة التفاعل. وأهمها أن الحالة الوسطية المتكونة تكون أكثر ثباتاً نتيجة لتراكب (Overlap) مدار العامل النيكليوفيلي مع مدار ذرة الكربون المركزية ومجموعة الكربونيل، كما هو موضح فيما يلي:
کما أن مجموعة الكربونيل تعمل على استقطاب العامل النيكليوفيلي عند اقترابه. مما يؤدي إلى كون الطرف المتقدم من النيكليوفيل أكثر سالبية مما يزيد من قوة العامل النيكليوفيلي.
خامساً/ التعويض على بيتـا (β)
– عند تفاعل المركبات التي لها الصيغة العامة: YCH2CH2X حيث:
Y = RCO , HCO, ROCO , NH2CO , NC , Cl , Br , I , Ph
– نجد أن سرعة تفاعلات SN1 تنقص مقارنة مع المركبات التي لا تحمل بدلاً في الموضع بيتا، ويرجع السبب إلى أن:
(1) الطنين الذي ناقشناه في الفقرة السابقة غير متوفر هنا.
(2) وجود المجاميع في وضع بيتا يقلل من تفاعلات S2 نتيجة للتزاحم وإعاقة اقتراب العامل النيكليوفيلي إلى الذرة المركزية.
سادساً/ تأثير المجاميع المعطية والساحبة للإلكترونات
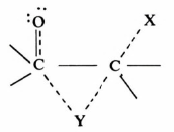
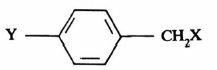
-عندما تقاس سرعة التفاعلات في سلسلة من المركبات تكون فيها المجموعة Y في وضع بارا بالنسبة لمركز التفاعل) ساحبة أو مانحة للإلكترونات فإن هذا يجعل التزاحم الفراغي بين المجموعة Y والمجموعة الخارجة X أقل ما يمكن .
وفي هذه الحالة فإن التأثير الإلكتروني هو المهيمن.
– ولقد وجد أن المجموعات الساحبة للإلكترونات تؤدي إلى نقصان معدل سرعة تفاعلات SN1. نظراً لأن هذه المجاميع تؤدي إلى عدم استقرار أيون الكربونيوم.
– بينما وجود المجاميع المعطية للإلكترونات يؤدي إلى زيادة سرعة تفاعلاتSN1
– وسبب زيادة معدل سرعة التفاعل في حالة المجموعات المعطية راجع إلى أن هذه المجاميع تؤدي إلى استقرار أيون الكربونيوم (أي انخفاض طاقته) وذلك بسبب ما يحدث من طنين للشحنة الموجبة على مركز التفاعل وموقع المجموعة المانحة للإلكترونات كما يتضح من صيغة الطنين التالي:
– أما في حالة تفـاعـلات SN2 فإن العلاقة بين معدل سرعة التفاعل والتأثير الإلكتروني للمجاميع المرتبطة على الحلقة العطرية يعتبر أكثر تعقيداً حيث إن لهذه المجاميع تأثيراً على سرعة كسر وتكون الرابطة في الحالة الوسطية وهذا عكس ما يحدث في ميكانيكية تفـاعـلات SN1
– فإذا كان التأثير الإلكتروني هو التأثير الوحيد فإن المجموعات الساحبة لا تعمل على زيادة تفاعلات SN2 ويعود ذلك إلى أن هذه المجاميع تؤدي إلى ثبات الحالة الوسطية بما تسببه من سحب جزء من الكثافة الإلكترونية .
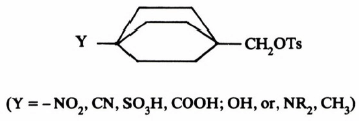
– كما أن المجموعات المانحة تعمل على إبطاء تفاعلات SN2 وذلك بزيادة الكثافة الإلكترونية على الحـالـة الـوسـطية.
وقد تبين ذلك من إجراء بعض التجارب على المركب: 4Y-bicyclo [2.2.2] octylmethyltosylate
سابعاً/ عندما تكون المادة المتفاعلة حلقية
-عندما تكون المجموعة X متصلة بحلقة غير مشبعة مثل البروبيل الحلقي فإن المادة المتفاعلة تقـاوم تفـاعـلات الاستبدال.
– مثال على ذلك التحلل المائي لمركب Cyclopropyltosylate يكـون أبـطأ بحـوالي 10 مليون مرة من التحلل المائي لمركب Cyclobutyltosylate في وجود حمض الخليك عند 60مo ويرجع السبب إلى:
(1) كبر التوتر الحلقي في حلقة البروبيل مقارنة مع حلقة البيوتيل .
(2) ويمكن إبداء سبب آخر لعدم نشاط البروبيل الحلقي هو أن رابطة σ في حلقة البروبيل لها صفات الرابطة π . وهذا يعني أن هاليدات البروبيل الحلقي تشبه في تركيبها الفاينايل .
وقد بينا سابقاً أن هاليدات الفاينايل غير نشطة تجاه تفاعلات SN1 أما في حالة هاليدات البروبيل الحلقي فإن مهاجمة العامل النيكليوفيلي يؤدي إلى فتح الحلقة بدلاً من حدوث تفاعلات الاستبدال كما في المعادلة التالية:
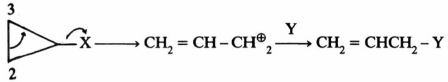
أما في حالة البيوتان الحلقي فإن الحالة تختلف كما هو واضح من المعادلة التالية:
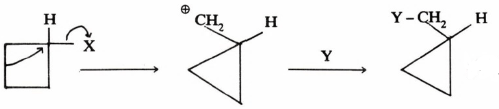
تقل سرعة تفاعلات الاستبدال بزيادة حجم الحلقة نتيجة نقصان التوتر الداخلي مع كبر حجم الحلقة . فلقد وجد أن التحلل لهاليدات الهكسان الحلقي (أو الحلقات من 7 – 11) يكون أبطأ من التحلل المائي لهاليدات البنتان الحلقي . ويرجع السبب إلى أن التوتر الحلقي في الحلقة الخماسية يحدث له ارتخاء في الحالة الوسطية.
ثامناً/ تأثير الجسور في المادة المتفاعلة Bridgeheads Substrate
– إن حدوث تفاعلات الاستبدال في المركبات الحلقية الحاوية على جسور شبه مستحيل فإن حدث فإنه يكون بطيئاً جداً.
– فعلى سبيل المثال، في تفاعلات SN2 يعيق التركيب الحلقي لهذه المركبـات اقتراب العـامـل النيكليوفيلي من الجهة المعاكسة للمجموعة المغادرة مما يحول دون حدوث التفاعل.
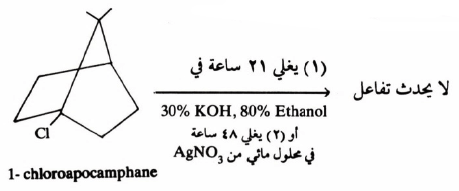
– ويختلف الأمر في حالة تفاعلات SN1 إذ تحدث هذه التفاعلات بسهولة خصوصاً عندما تكون الحلقة كبيرة نظراَ لثبات أيون الكربونيوم المتكون والذي يمكن فصله أيضاً، كما في حالة أيون 1bicyclo [3.2.2] nonyl cation .
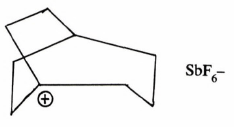
حيث يمكن حفظه في محلول من SF5 – SO2CIF عند درجة – 50مo.
تاسعاً/ تأثير التعويض بنظير الهيدروجين Deuterium Substitution
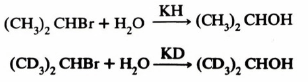
– بينت الدراسات على أن التعويض على ذرة الكربون الفا وبيتا بالديتيريوم وتأثيره على معدل سرعة التفاعل ينتج عنه تأثير ثانوي لا علاقة له بكسر رابطة المجموعة الخارجية X
– دراسة التأثير الثانوي للنظائر على ذرة الكربون الفا يقدم لنا دليلاً على ميكانيكة التفاعل وتمييزها إن كانت SN1 أو SN2
– فقد وجد أنه في تفاعلات SN2 تكون قيمة KH/KD تتراوح بين 0.95 – 1.06 عند استبدال هيدروجين الفا بالديتيريوم. بينما في تفاعلات SN1 تكون القيمة أكبر من ذلك.
– وعند وجود الديتيريوم على ذرة الكربون بيتا فإن معدل سرعة التفاعل تقل. حيث وجد أن قيمة KH/KD هي في حدود 1.34 للتفاعلين التاليين:
– وقد يكمن السبب هنا في وجود عملية الدعم الإلكتروني (Hyperconjugation) في الحالة الوسطية.
تلخيص العناصر السابقة
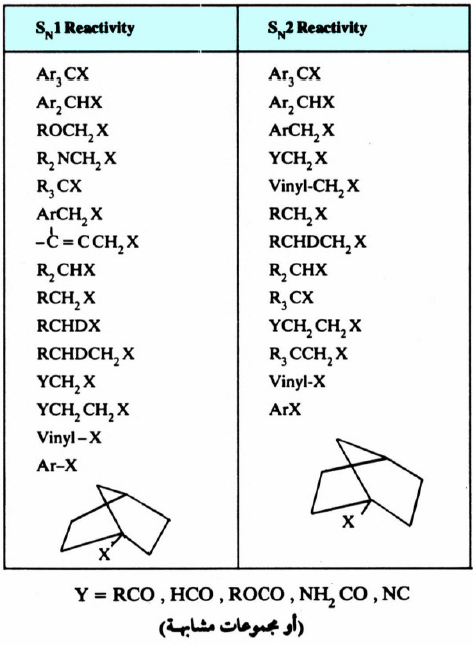
– ويمكن تلخيص ما سبق دراسته من تأثير بنية المادة المتفاعلة على كل من تفاعلات SN1 و SN2 في الجدول التالي:
– الجدول يوضح تأثير تركيب المادة المتفاعلة تجاه تفاعلات SN1 و SN2 (مرتبتان ترتيباً تنازلياً)
المراجع: كتاب ميكانيكية التفاعلات العضوية ، تأليف/ د.سالم بن شويهان ، د. إبراهيم بن محمود النجار ، د. حمد بن عبدالله اللحيدان ، الرياض – جامعة الملك سعود – الطبعة الثانية 2003م