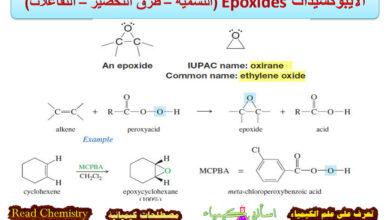
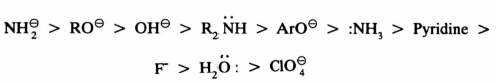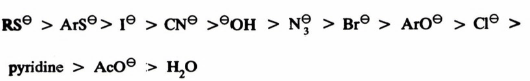تأثير المجموعة المهاجمة Nucleophile على تفاعلات SN1 , SN2
في الموضوعات السابقة تم مناقشة تفاعلات الاستبدال النيكليوفيلية SN1 ، SN2 وكذلك تم مناقشة تأثير بنية المادة المتفاعلة على تفاعلات الاستبدال النيكليوفيلية SN1 , SN2 . والآن سيتم مناقشة تأثير المجموعات المهاجمة Attacking Nucleophileعلى تفاعلات الاستبدال SN1 , SN2
العوامل المؤثرة على تفاعلات الاستبدال النيكليوفيلية
(1) تأثير بنية المادة المتفاعلة Substrate Structure
(2) تأثير المجموعات المهاجمة Attacking Nucleophile
(3) تأثير المجموعة المغادرة leaving group
أضغط على أي عنصر مما سبق لقراءته.
تأثير المجموعة المهاجمة Attacking Nucleophile على تفاعلات الاستبدال SN1 , SN2
– إن العامل النيكليوفيلي Nucleophile عبارة عن أية ذرة أو جزئ يحمل زوجاً من الإلكترونات الحرة.
– وقد يكون العامل النيكليوفيلي Nucleophile ذا شحنة سالبة أو متعادل الشحنة Lewis base
– لقد سبق وبينا أن تفاعلات SN1 لا تتأثر بالعامل النيكليوفيلي Nucleophile. حيث إنه لا يدخل في الخطوة البطيئة المحددة لسرعة التفاعل. بمعنى أنه لا يظهر في قانون السرعة المحددة للتفاعل.
– فمثلاً وجد أن BuBr والذي يتبع في تفاعله مع الماء ميكانيكية SN1 لا يتأثر عند تغيير العامل النيكليوفيلي من الماء إلى الهيدروكسيل.
– وبالمقابل فإن المواد المتفاعلة التي تتبع ميكانيكية SN2 مثل CH3Br. نجد أنه تزداد سرعة التفاعل 5000 مرة عند تغيير العامل النيكليوفيلي من الماء إلى مجموعة الهيدروكسيل.
– مع العلم أن تغيير الـعـامـل النيكليوفيلي في تفاعلات SN1 يؤدي إلى تغيير الناتج. ويتضح ذلك من تحلل Benzyl tosylate بالميثـانـول حيث يكون النـاتـج Benzyl methyl ether. أما عند استخدام عامل نيكليوفيلي أقوى مثل –Br فإن الناتج يكون Benzyl bromide وسرعة التفاعل لا تتغير.
– أما في حالة تفاعلات SN2 فإن هناك أربعة عوامل أساسية تتحكم في تأثير العـامـل النيكليوفيلي على سرعـة التفـاعـل. كما أن ترتيب النيكليوفيلية (Nucleophilicity order) يكون غير ثابت. ولكنه يعتمد على المادة الأم، والمذيب، والمجموعة المهاجرة ، ….. الخ.
العوامل الأربعة التي تتحكم في تأثير العامل النيكليوفيلي Nucleophile على سرعة تفاعلات SN2
أما العوامل الأربعة التي تتحكم في تأثير العامل النيكليوفيلي على سرعة تفاعلات SN2 فيمكن تلخيصها فيما يلي:
(1) العامل النيكليوفيلي Nucleophile الذي يحمل شحنة سالبة يكون دائما نيكليوفيل قوي.
(2) تتمتع العناصر من نفس الدورة في الجدول الدوري بصفات نيكليوفيلية مشابهة للصفات القاعدية تقريباً
(3) تزداد النيكليوفيلية وتقل القاعدية عند التدرج من أعلى الجدول الدوري إلى أسفل في نفس المجموعة.
(4) النيكليوفيل الطليق: كلما كان العامل النيكليوفيلي سريع الحركة كلما كان أسرع في مهاجمة المادة المتفاعلة
وسنقوم بشرح كل عامل من تلك العوامل بالتفصيل كما يلي:
أولاً/ العامل النيكليوفيلي Nucleophile الذي يحمل شحنة سالبة يكون دائما نيكليوفيل قوي.
– العامل النيكليوفيلي الذي يحمل شحنة سالبة يكون دائما نيكليوفيل قوي بالمقارنة مع الحمض المرافق له (Conjugate acid) عندما يكون الأخير أيضاً عامل نيكليوفيلي .
– وعليه فإن OH- تكون أكثر نيكليوفيلية من NH2 ، H2O– . وهكذا يتضح ذلك من أمثلة أخرى في فقرة (2) .
ثانياُ/ تتمتع العناصر من نفس الدورة في الجدول الدوري بصفات نيكليوفيلية مشابهة للصفات القاعدية تقريباً
– تتمتع العناصر من نفس الدورة في الجدول الدوري بصفات نيكليوفيلية مشابهة للصفات القاعدية تقريباً لأن كلتا الخاصيتين (القاعدية والنيكليوفيلية) يتحكم فيها زوج إلكتروني من الممكن منحه للمادة المتفاعلة.
المقارنة بين القاعدية والنيكليوفيلية
– وللمقارنة بين القاعدية والنيكليوفيلية فنجد أن:
(1) النيكليوفيلية هي قدرة العامل النيكليوفيلي على إعطاء زوج الإلكترونات الحر للذرة المركزية. بينها القاعدية هي القدرة على إعطاء الزوج الإلكتروني للبروتون.
(2) النيكليوفيلية تتأثر تأثراً كبيرا بالتزاحم الفـراغي.
(3) تعبر النيكليوفيلية أيضا عن مقدار سرعة التفاعل الذي يتم نتيجة اتحاد العامل النيكليوفيلي مع ذرة الكربون المركزية، أي أن النيكليوفيلية تمثل مفهوما حركياً (Kinetics) أما القاعدية فتعبر عن مقدار التوازن القائم في تفاعل حمض مع قاعدة، وعليه فإن وضع التوازن هذا يتعلق بعوامل حركية حرارية (Thermodynamics)
ولذلك فالعـامـل النيكليوفيلي يمثـل قاعـدة تتفاوت من حيث ميلها للتفاعل مع البروتون. ويمكن وضع ترتيب تقريبي للنيكليوفيلية كالتالي:
كذلك الحال في الترتيب التالي:
ثالثاً/ تزداد النيكليوفيلية وتقل القاعدية عند التدرج من أعلى الجدول الدوري إلى أسفل في نفس المجموعة.
– تزداد النيكليوفيلية وتقل القاعدية عند التدرج من أعلى الجدول الدوري إلى أسفل في نفس المجموعة ويتضح ذلك عند استخدام الهالوجينات كعوامل نيكليوفيلية حيث نجد أن ترتيب النيكليوفيلية فيها كالتالي:
– يجب أن يؤخذ في الاعتبار هنا أن هذا الترتيب يعتمد على المذیب کما سنرى فيها بعد.
– يتضح أيضاً أن العامل النيكليوفيلي الحاوي على الكبريت يكون أكثر قوة من مثيله الذي يحتوي على الأكسجين، كذلك ينطبق الحال على الفوسفور والنتروجين.
– كما أنه لا تقتصر قوة النيكليوفيلية على الزوج الإلكتروني وحده، بل إن هناك عاملاً أساسياً وهو قدرة العامل النيكليوفيلي على الحل (Solvation) أي القدرة على انتشار الشحنة السالبة أو الزوج الإلكتروني على مسافة أكبر، ولهذا فإن أيونات العناصر الأكبر حجماً، تكون أعلى نيكليوفيلية، من العناصر الأصغر حجماً.
أمثلة توضيحية
يتفاعل n-Butylbromide مع كل من (–ArO– & ArS–) Thiophenolate, Phenolate ومع أن فينولات الصوديوم أقوى قاعدية من ثيوفينولات الصوديوم، إلا أن سرعة تفاعل ثيوفينولات الصوديوم أكبر بألف مرة من سرعة فينولات الصوديوم ، ويرجع ذلك إلى أن الشحنة السالبة على عنصر الكبريت تجد سطحاً كروياً أوسع تنتشر عليه مما تجده على عنصر الأكسجين في فينولات الصوديوم . كما هو الحال بالنسبة للأيوديد والفلور مثلاً.
– إن المذيبات القطبية البروتونية ((protic مثل الميثانول والماء، تقوم جزيئاتها بتكوين هالة حول العـامـل النيكليوفيلي فتحول دون وصـوله بسهولة إلى الذرة المركزية في المادة المتفاعلة، كما أنها تستطيع تكوين روابط هيدروجينية، ولهذا فالأيون الصغير كأيون الفلور مثلاً يتطلب طاقة عالية حتى يتمكن من الخروج من هذه الهالة، ومن هنا كان إجـراء التفاعل في مذيبات قطبية غير بروتونية ((Aprotic) مثل ثنائي مثيل السلفوكسيد:
فهذا النوع من المذيبات لا يكون هالة کما لا يساعد على تكوين الروابط الهيدروجينية مما يتيح للعامل النيكليوفيلي قدرة أكبر للوصول إلى الذرة المركزية وبالفعل فقد وجد أن أيون F– المتوفر في مذيب من النوع الثاني (Aprotic) مثل D.M.F., CH3CN يقوم بدور الاستبدال، حتى ولو كانت ذرة الكربون المركزية في المادة المتفاعلة أولية أو ثانوية أو حتى ثالثيه.
رابعاً/ النيكليوفيل الطليق
– النيكليوفيل الطليق: يعطي العامل النيكليوفيلي الطليق (الحر) سرعة تفاعل عظيمة مقـارنة مع النيكليوفيل غير الطليق.
– ونعني بهذا القول إنه كلما كان العامل النيكليوفيلي سريع الحركة كلما كان أسرع في مهاجمة المادة المتفاعلة.
– ويتضح ذلك من المثال التالي:
إن سرعة تفاعل الاستبدال بواسطة العامل النيكليوفيلي في البنزين تزداد زيادة كبيرة عند إضافة مادة (1.2Dimethoxyethane) حيث تعمل هذه المادة هالة حول أيون الصوديوم، وبذلك يصبح العامل النيكليوفيلي طليقاً.
أما عند إجراء التفاعل في مذيب غير قطبي مثل البنزين فقط فإن العامل النيكليوفيلي Nucleophile وأيون الصوديوم يظلان مرتبطين على شكل أيون مزدوج ((Ion-pair) ووزنه الجزئي لا يقل عن 1000.
ومثال آخر فقد وجد أن إضافة الايثر التاجي (Crown ethers) يعمل على زيادة سرعة التفاعلات التي يكون فيها العامل النيكليوفيلي أحد العوامل التالية:
الخلاصة
– وفي النهاية يمكن القول إن العوامل الأربعة السابقة قد لا تكفي، فقد وجد مثلاً أن عامـل التـزاحم مهم أيضا في تحديد سرعة التفـاعـلات.
– فعلى سبيل المثال أيون البيوتوكسايد الثالثي –Me3CO أقوى قاعدية من OH– أو –OEt لكنه أقل نيكليوفيلية منها ويرجع السبب إلى كبر حجمه الذي يمنعه من الاقتراب من ذرة الكربون المركزية في المادة المتفاعلة. كذلك الحال عند مقارنة سرعة تفاعلات البيريدين ومشتقاته كعوامل نيكليوفيلية مع CH3-I في وسط نيتروبنزين عند 25co. نجد أن هناك تفاوتا كبيرا في سرعة التفاعل كما هو واضح مما يأتي:
يلاحظ في حالة R = 2.6 – di tBu أن التفاعل يحتاج إلى ضغط شديد وتكون السرعة بطيئة جداً بالمقارنة مع البيريدين (R = H)
ويتضح أيضاً من الجدول السابق أن وجود المجاميع في وضعي (2) , (6) يخفض من سرعة التفاعل .
أما الوضع (4) فلا يمثل عائقاً فراغياً بالنسبة لمركز ذرة النيتروجين بل يدعم هذا المركز إلكترونياً . فالأثر الفراغي التزاحمي واضح جدا في الأمثلة المختلفة السابقة.
– ويمكن تلخيص ترتيب العوامل النيكليوفيلية حسب قدرتها لتفاعلات SN2 في وجود مذيب قطبي بروتوني ( (Protic) كالتالي:
المراجع: كتاب ميكانيكية التفاعلات العضوية ، تأليف/ د.سالم بن شويهان ، د. إبراهيم بن محمود النجار ، د. حمد بن عبدالله اللحيدان ، الرياض – جامعة الملك سعود – الطبعة الثانية 2003م