طرق تحضير الكحولات Preparation of Alcohols
– فى الموضوعات السابقة عن الكحولات فقد تم مناقشة موضوع تسمية وتصنيف الكحولات، وفى هذا الموضوع سوف نتحدث عن طرق تحضير الكحولات
محتويات الموضوع
طرق تحضير الكحولات Preparation of Alcohols
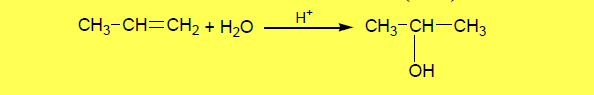
(1) إماهة الألكينات Hydration of alkenes
– يتم تحضير الكحولات بواسطة إضافة الماء للألكين في وسط حمضي حيث تتبع الإضافة قاعدة ماركونيكوف كما بالمعادلة الآتية:
– حيث يضاف حمض الكبريتيك المركز البارد للألكينات لتتكون كبريتات ألكيل هيدروجينية وبحسب قاعدة ماركينكوف التى تتعرض بعد ذلك للتحلل المائي لتعطي الكحولات.
– ويحضر الإيثانول صناعياً بإماهة الإيثيلين المستمد من النفط الخام كما يلي:
أو
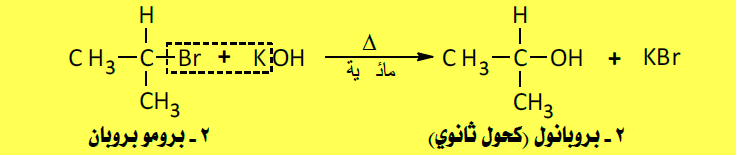
(2) تحضير الكحولات من هاليدات الألكيل Alkyl halide
– يمكن تحضير الكحولات بتسخين هاليدات الألكيل التى يتكون شقها الألكيلي من الشق الألكيلي للكحول المطلوب مع المحاليل المائية للقلويات القوية مثل هيدروكسيد الصوديوم، فتحل مجموعات الهيدروكسيل محل شق الهاليد ويتكون الكحول المقابل.
أولاً/ تحضير الكحولات الأولية
ثانياً/ تحضير الكحولات الثانوية
ثالثاً/ تحضير الكحولات الثالثية
ترتيب الهالوجينات حسب سهولة انتزاعها من هاليد الألكيل كما يلي:
اليود < البروم < الكلور
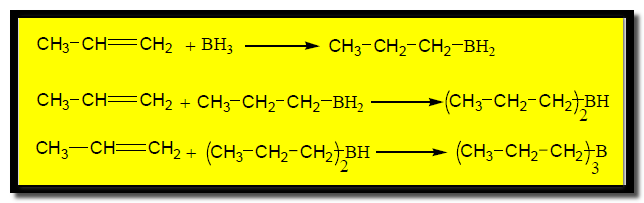
(3) إماهة الألكينات بواسطة ثلاثي هيدريد البورون (البوران)
Hydration of alkene with trihydridboron (borane)
– يتم تميه الألكين باستخدام ثلاثي هيدريد البورن حيث تُضاف الرابطة B-H من البورن إلى الألكين فيتكون ناتج يسمى organoborane
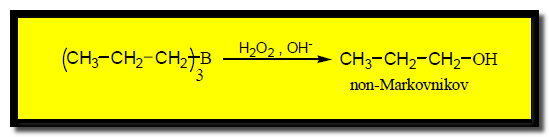
– وعند تفاعل ثلاثي الألكيل بورن مع محلول مائي من فوق أكسيد الهيدروجين في وسط قاعدي ينتج كحول بإضافة عكس قاعدة ماركونيكوف كما بالمعادلة الآتية:
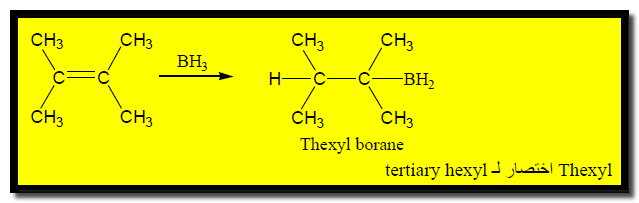
– يعتمد ناتج هذا التفاعل على حجم الألكين حيث تسبب الإعاقة المجسامية توقف التفاعل عند الخطوة الأولى أو الثانية فعلى سبيل المثال المركب يتفاعل مع البورن ويعطي ناتج واحد فقطmonoalkyl borane بسبب الإعاقة الفراغية.
– ويمكن بنفس الطريقة الحصول على نفس النتائج السابقة فى حالة استخدام مركب ثنائي البوران B2H6 بدلاً من ثلاثي هيدريد البورون ( البوران) BH3
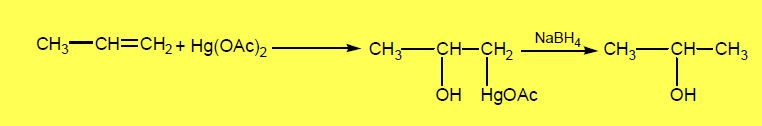
(4) تفاعل الألكينات مع أسيتات الزئبقيك Oxymercuration-demercuration
– علاوة على ذلك فأنه يتم تحضير الكحولات من تفاعل الألكينات مع أسيتات الزئبقيك حيث تضاف عناصر الماء إلى الألكينات بطريقة غير مباشرة وذلك باستخدام اسيتات الزئبقيك فى مخلوط من الماء ورباعي هيدرو فيوران THF ، ويؤدي هذا إلى تكون مركب وسيط (هيدروكسي ألكيل زئبقيك) تتصل فية ذرة الزئبق بذرة الكربون الاقل إستبدالاً (في الألكين).
– فإذا ما اختزل هذا المركب الوسيط باستخدام هيدريد صوديوم البورون NaBH4 في محلول قاعدى حلت ذرة الهيدروجين محل ذرة الزئبق ويتكون كحول حسب قاعدة ماركنيكوف كما بالمعادلة الآتية:
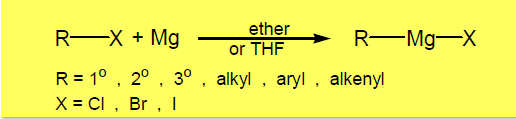
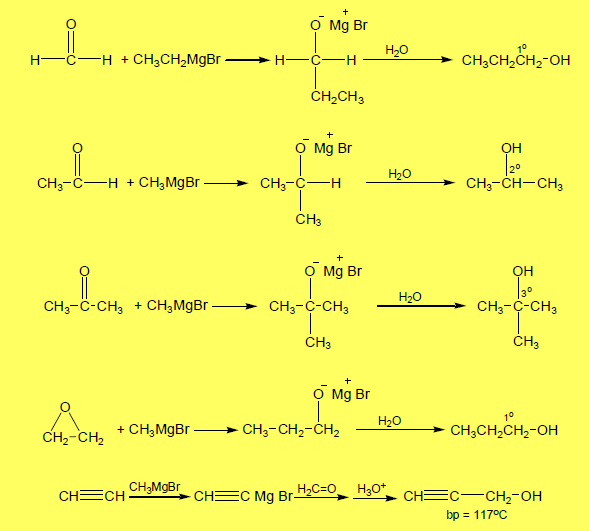
(5) تفاعل كاشف جرينارد مع مركبات الكربونيل Grignard reaction
– يتفاعل كاشف جرينارد RMgX مع مركبات الكربونيل والإيبوكسيدات والألكاينات الطرفية.
- عند استخدام فورمالدهيد فأننا نحصل على كحول أولي
- ونحصل على كحول ثنائي إذا ما استخدمت اسيتالدهيد
- ويتكون كحول ثالثي إذ استخدم أسيتون
– كما يتضح من المعادلات التالية بالطرق الآتية:
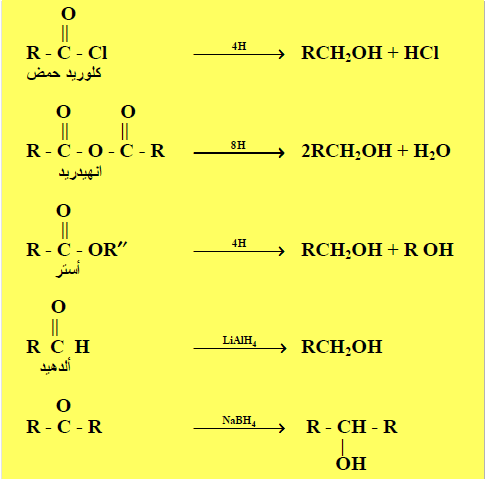
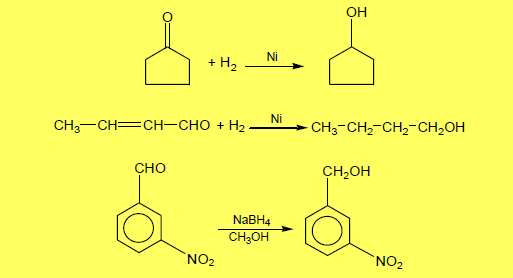
(6) اختزال مركبات الكربونيل Reduction of Carbonyl compounds
– يتم اختزال مجموعة الكربونيل إلى مجموعة هيدروكسيل حيثيضاف الهيدروجين إلى مجموعة الكربونيل في الألدهيدات أو الكيتونات وكذلك الأحماض الكربوكسيلية وكلوريدات الأحماض والأنهيدريدات والاسترات وذلك باستخدام مكوناً كحولات أولية و كحولات ثانوية
– وذلك باستخدام العوامل التالية في وجود الهيدروجين : (RONa) , (NaBH4) , (LiAlH4) , (Ni , Pt or Pd)حيث لا تؤثر العوامل المختزلة (NaBH4 or LiAlH4) على روابط C-C المتعددة.
– يختزل هيدريد الصوديوم مجموعة الفورميل فقط ولا يختزل مجموعة النيترو .
(7) اختزال الألدهيدات والكيتونات Aldehydes and KetonesReduction of
– تختزل الألدهيدات والكيتونات بغاز الهيدروجين وعامل حفاز (مثل النيكل أو برادة النحاس) أو باستخدام (NaBH4) أو (LiAlH4) لتعطي كحولات أولية من الألدهيدات وثنائية من الكيتونات كما بالمعادلات الآتية:
– وإذا وجدت رابطة مزدوجة فى الجزئ ، فإن الهيدريدات الفلزية تختزل مجموعة الكربونيل دون المساس برابطةC=C
(8) اختزال الأحماض الكربوكسيلية Reduction of Carboxylic acids
– يتم اختزال الأحماض الكربوكسيلية (مجموعة الكربوكسيل) إلى كحولات أولية باستخدام LiAlH4
– ولا يستخدم NaBH4 لأنه أقل حامضية من LiAlH4 وذلك لأن الرابطة Al-H تكون أكثر قطبية من الرابطة B-H
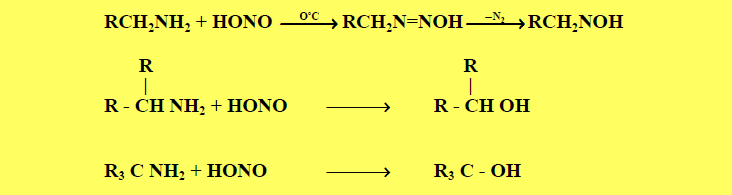
(9) تحضير الكحولات من الأمينات Amines
– تتم معالجة الأمينات بحمض النيتروز (NaNO2 + HCl) لنحضر بعض الكحولات الخاصة كما يلي:
(10) الطرق الصناعية لتحضير الكحولات
(أ) تحضير الميثانول Methanol

(ب) تحضير الأيثانول Ethanol
– ويحضر الإيثانول صناعياً بإماهة الإيثيلين المستمد من النفط الخام وذلك بمعاملة الإثيلين بحمض الكبريتيك ، ثم تحلل السلفات الناتجة بوساطة الماء.
– إلا أن الطريقة الحديثة تتضمن إضافة الماء مباشرة إلى الإثيلين عند درجة حرارة وضغط مناسبين وبوجود عامل مساعد كما بالمعادلة الآتية:
المراجع :
- أسس الكيمياء العضوية . وائل غالب محمد – وليد محمد السعيطي ، الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا
- أساسيات الكيمياء العضوية. محمد مجدي واصل ، جامعة الأزهر – جمهورية مصر العربية


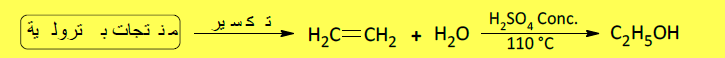
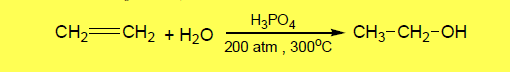

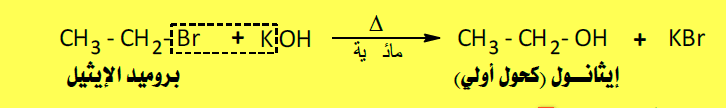

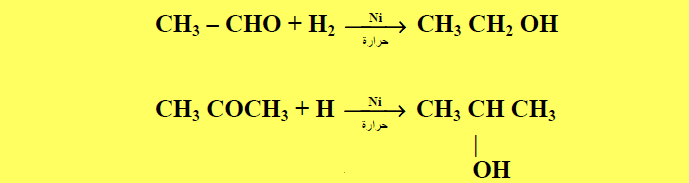
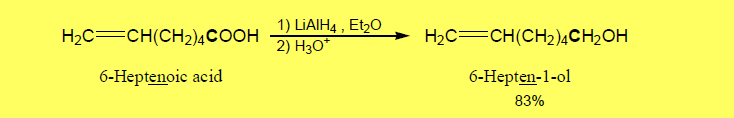
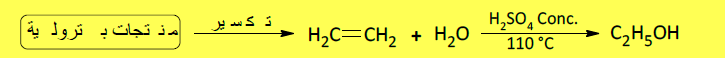
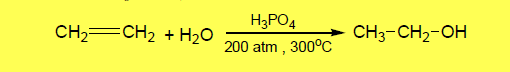




شكرا