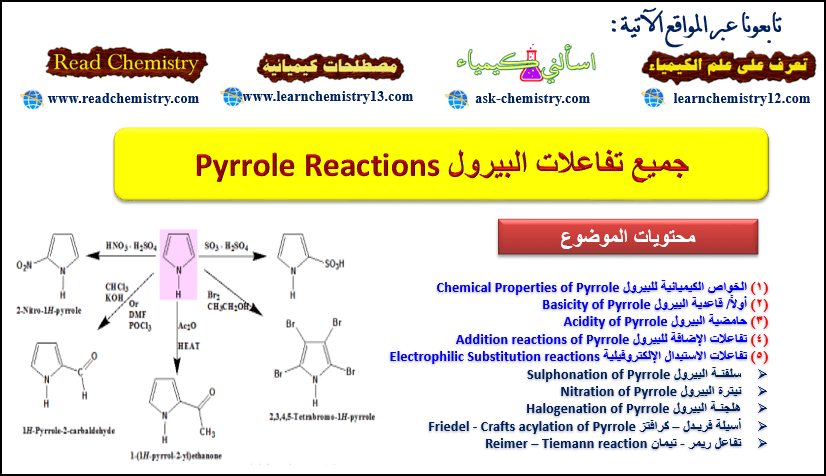
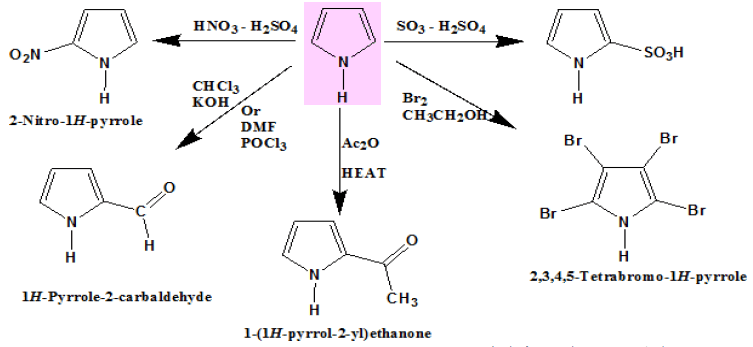
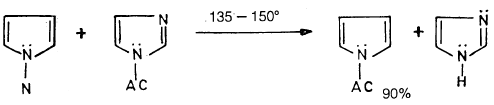تفاعلات البيرول Pyrrole Reactions
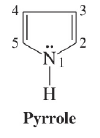
فى الموضوع السابق تم مناقشة تحضير البيرول. وفي هذا الموضوع سيتم مناقشة جميع تفاعلات البيرول Pyrrole Reactions مع ذكر المعادلات التوضيحية. كما يرجى الانتباه إلى ترقيم الأعداد الموجود على حلقة البيرول لأنه تم استخدامه بكثرة في هذا الموضوع:
الخواص الكيميائية للبيرول Chemical Properties of Pyrrole
– من أهم ما يميز البيرول هو تصرفـه كـمـركب عطري نشط تجاه الكواشف الإلكتروفيلية. ويمكن مقارنته بالفينول.
– البيرول له صفات حمضية وقاعدية ضعيفة.
– يمكن أن يتفاعل مثل الإينامين (Enamine). وكذلك مثل 1,3- دايين (Diene – 1,3) في تفاعله مع بعض الكواشف النشطة.
– تعطي كثير من البيرولات نتيجة إيجابية لتفاعل إيرلش ( Ehrlich reaction). وهو ظهور لون أحمر إلى بنفسجي عند التفاعل مع 4- ثنائي مثيل أمينوبنز الدهيد وحمض الهيدروكلوريك المركز.
– أغلب البيرولات تعطي مركبات الآزو الملونة مع أملاح الديازونيوم.
أولاً/ قاعدية البيرول Basicity of Pyrrole
يوصف البيرول بأنه قاعدة ضعيفة جداً. وذلك لعدة أسباب منها أن زوج الإلكترونات الحر يعد من ضمن الإلكترونات المكونة للسحابة الإلكترونية للبيرول. والتي تجعله يحقق الصفة الأروماتية حسب قاعدة هوكل (4n+2). وهذا يجعل ذرة النتروجين أقل قابلية لاستقبال أي بروتون من وسط التفاعل.
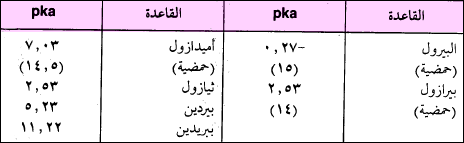
– يوضح الجدول التالي قاعدية بعض مركبات النتروجين غير المتجانسة وحمضيتها.
– كذلك فإن للوضع الفراغي لذرة النتروجين أهمية في هذا الخصوص.
– في الوسط الحمضي المخفف فإن البيرول يقوم بضم البروتونات إلى موضعي (2) أو (3) مما ينتج عنه كاتيونات أكثر ثباتاً من تلك التي تنتج عن إضافة البروتون إلى ذرة نتروجين البيرول مباشرة.
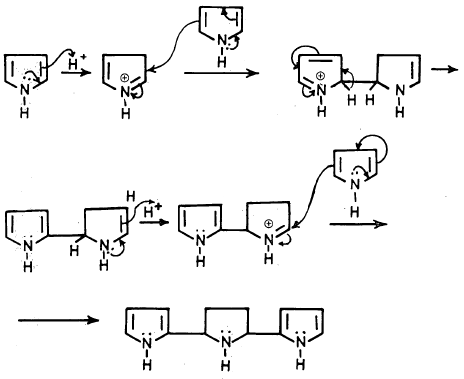
– أما عندما يوضع البيرول في وسط حمضي مركز مثل 5.5M HCl ودرجة حرارة صفر لمدة ثلاثين ثانية فإنه يتم الحصول على بلورات لبوليمر ثلاثي كما تبين المعادلة التالية:
هذا ويمكن اعتبار هذا التفاعل من تفاعلات الإضافة الإلكتروفيلية للبيرول.
ثانياً/ حامضية البيرول Acidity of Pyrrole
– للبيرول مميزات كثيرة من أهمها أنه يمكن أن يتصرف وكأنه حمض ضعيف. حيث تقدر Ka له بحوالي 5-10 تقريباً (الجدول السابق).
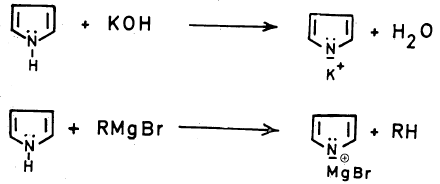
-هذه الخاصية أوضح ما يمكن إذا ما تفاعل مع قواعد قوية مثل المعادن القلوية أو هيدروكسيداتها كالبوتاسيوم وكذلك المركبات العضوية المعدنية مثل كاشف جرينارد حيث تتكون الأملاح المطابقة والتي لها استخدامات تحضيرية مهمة. والمعادلات الآتية تبين ذلك:
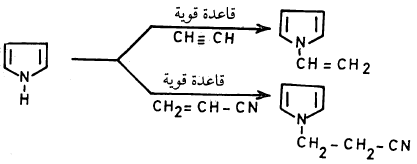
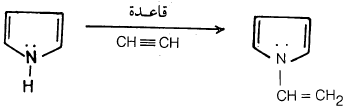
– وعلى العموم فإن البيرول يمكن أن يتفاعل مع الأستلين ونيتريل الأكرولين في وجود قاعدة قوية كعامل مساعد.
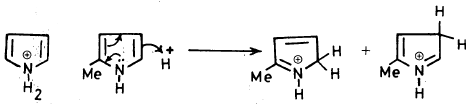
– وإذا ما قورنت حمضية الأمونيا ومشتقاتها الأليفاتية مع البيرول نجد أن البيرول أكثر حمضية منها وذلك لعدة أسباب منها:
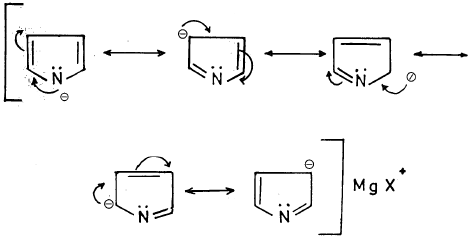
(أ) أن الأيون الناتج من نزع بروتون البيرول يكون أكثر ثباتاً من البيرول نفسه. وذلك أن ذرة النتروجين ذات الكهروسالبية العالية تصبح غنية بالإلكترونات. مما يسهل عليها المشاركة بزوجها الإلكتروني الحر في تكوين سحابة باي ((π – Cloud) کما أن الأيون الناتج له تراكيب تأرجحية أكثر ثباتاً من تلك التي للبيرول نفسه. وذلك بسبب عدم وجود أي فصل لشحنات عليها.
ويمكن تمثيل التراكيب التأرجحية لأنيون البيرول كالتالي:
(ب) زوج إلكترونات الرابطة (N-H) يكون أقرب إلى ذرة النتروجين في حالة البيرول منه في حالة الأمونيا أو مشتقاتها الأليفاتية وهذا يجعل ذرة الهيدروجين في البيرول أكثر حمضية.
ومما يجدر ذكره هنا أن وجود مجموعات ساحبة للإلكترونات على حلقة البيرول يزيد من صفاتها الحمضية.
ثالثاً/ تفاعلات الإضافة للبيرول Addition reactions of Pyrrole
(1) اختزال البيرول Reduction of Pyrrole
– يؤدي اختزال البيرول إلى الحصول على عدد من النواتج حسب ظروف التفاعل.
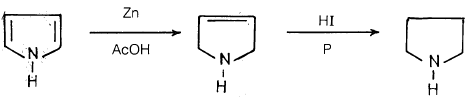
– فالبيرول يمكن أن يختزل بواسطة الزنك وحمض الخل ليعطي 3- بيرولين ويسمى أيضا 5,2- ثنائي هيدروبيرول (2.5Dihydropyrrole) وهذا يمكن أن يختزل إلى البيرولدين Pyrrolidine (تتراهيدروبيرول) (Tetrahydropyrrole) بتسخينه مع حمض يوديد الهيدروجين والفسفور الأحمر، كما هو مبين بالمعادلة التالية:
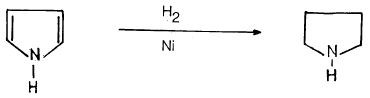
– هذا مع العلم أنـه يمكن اختزال البيرول إلى البيرولـديـن (Pyrrolidine) مبـاشرة بالهيدروجين وعامل مساعد مثل النيكل وتحت الضغط العالي.
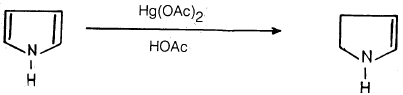
– أمـا عنـد استخدام الصوديوم في الإيثانول فإنه لا يحدث أي تفاعل. وعند استخدام خلات الزئبق في حمض الخل فإنه يتم الحصول على ٢- بيروليدين .
(2) تفاعلات أملاح البيرول Reactions of Pyrrole salts
– لقد قمنا بشرح الصفة الحمضية للبيرول. وذكرنا أنه يستطيع أن يكون أملاح مع القواعد القوية والمعادن القلوية. وهذه الأملاح يمكن أن تكون لها فوائد تحضيرية كما يتبين ذلك من المعادلات الآتية:
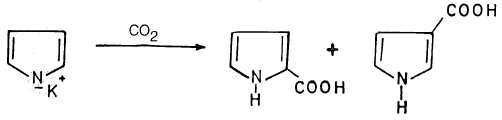
حيث يستطيع ملح بيرول البوتاسيوم ( Pyrrole potassium) أن يتفاعل مع ثاني أكسيد الكربون معطياً ناتج استبدال في موضع (۲) بصورة رئيسة وموضع (3) بصورة أقل .
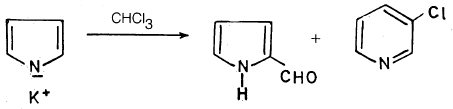
– كما يمكن لهذا الملح أن يتفاعل مع الكلورفورم (تفاعل ريمر – تيمان) معطياً بيرول – 3 – الدهيد بصورة رئيسية، بالإضافة إلى ناتج تحول موضعي عبارة عن 3-کلوروبيريدين بنسبة أقل.
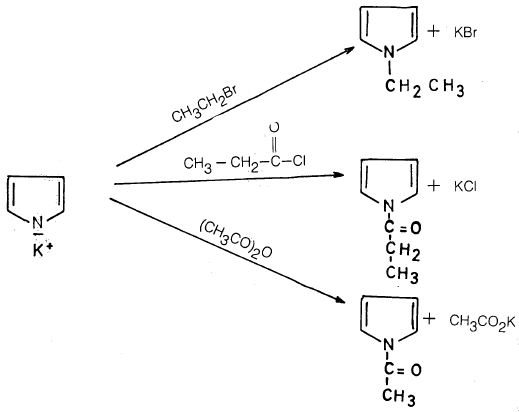
ويعتبر أيون البيرول عامل نيكلوفيلي قوي فهو يتفاعل مع هاليدات الألكيل وكلوريدات الحموض وكـذلـك الحموض اللامائية معطياً ناتج استبدال على ذرة النتروجين عند درجة الحرارة المنخفضة، أما عند درجة الحرارة العالية فإن الناتج الرئيسي عبارة عن استبدال في موضع ٢ـ وهذا يتم من خلال عملية تحول موضعي.
– وللمذيب والعامل المساعد أكبر الأثر في تحديد نسبة الناتج ونوعه ويستطيع بيرول في وجود قاعدة كعامل مساعد أن يتفاعل مع الإستلين وكذلك المركبات غير المشبعة الأخرى مثل أسيتيل نيتريل (Acetyinitrile)
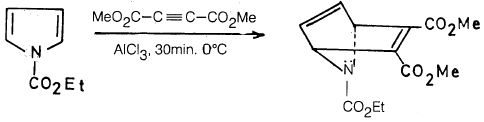
– ومن جهة أخرى تستطيع بعض مشتقات البيرول مثل 1- إيثوكسي كربونايل بيرول (1-Ethoxycarbonylpyrrole) أن تقوم بتفاعل دييلز – الدر كما تبين ذلك المعادلة التالية :
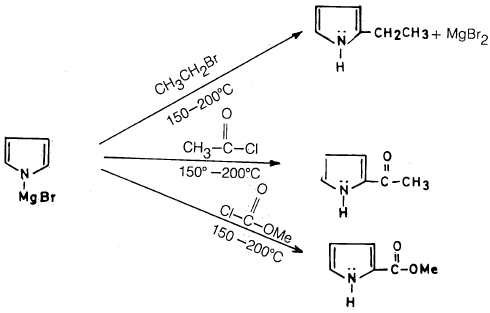
وقد سبقت الإشارة إلى أن البيرول يتفاعل مع مركبات جرينارد، ويعطي ملحاً يشبه مركب جرينارد، يتفاعل بدوره مع الكواشف الإلكتروفيلية في موضع 2- وبصورة أقل في موضع 3- وقليل جدا في موضع 1-.
– وعلى سبيل المثال فإن بيرول مغنيسيوم بروميد يتفاعل مع هاليد الألكيل وكلوريد الأستيل وكذلك مثيل كلوروفورميت عند درجة حرارة 150-200مo ويعطي بصورة رئيسة النواتج التالية:
أما عند درجة الحرارة المنخفضة فإنه يعطي خليط الاستبدال في موضعي 2- و 3-.
رابعاً/ تفاعلات الاستبدال الإلكتروفيلية Electrophilic Substitution reactions
– في تفاعلات الاستبدال التي تتم على ذرة النتروجين يتصرف البيرول وكأنه حمض ضعیف جداً.
– وعلى أية حال فإن أنيون البيرول يعتبر ذا صفة عطرية أكثر من البيرول نفسه وقد سبق التعرض لبعض التفاعلات التي تدل على حمضية البيرول.
– أما عملية الاستبدال على ذرة الكربون فإن البيرول يُهاجم من قبل الكواشف الإلكتروفيلية بسرعة وبصورة رئيسية في موضع 2ـ ، 5– وقد سبق وأن أشرنا إلى ظاهرة إضافة البروتون في الوسط الحمضي.
– ومن تفاعلات الاستبدال الإلكتروفيلية التي يقوم بها البيرول :
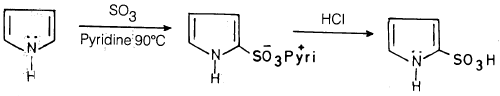
(1) سلفنـة البيرول Sulphonation of Pyrrole
– لا يمكن سلفنـة البيرول تحت الظروف العادية للسلفنة لأنه تحت تلك الظروف تحدث له بلمرة.
– أما في وجود البيريدين وثالث أكسيد الكبريت فإنه يتكون معقد Pyridinium 2. pyrrole sulphonate والذي يتحلل بواسطة HCl کما تبين المعادلة التالية:
والحمض الناتج مادة بلورية ماصة للمادة (Hygroscopic) بصورة قوية جداً.
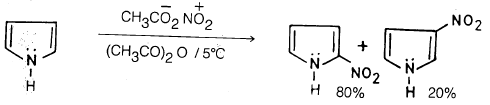
(2) نيترة البيرول Nitration of Pyrrole
– عند نيترة البيرول تحت الظروف العادية للنيترة وهي خليط من حمض الكبريتيك وحمض النيتريك فإنه يصعب الحصول على ناتج محدد .
– ولكن نيترة البيرول تتم بواسطة حمض النيتريك أو خلات النيتريك في وجود حمض الخل اللامائي، وعند درجة حرارة منخفضة . وبهذه الطريقة نحصل على 2- نيتروبيرول و3- نيتروبيرول بنسبة 4 : 1 على التوالي .
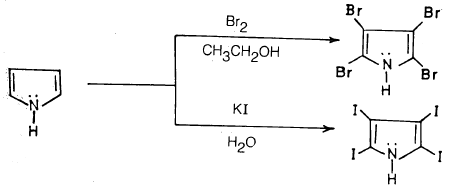
(3) هلجنـة البيرول Halogenation of Pyrrole
– يتفـاعـل البيرول مع الهالوجينات بصورة سريعة جداً. فهو يتفاعل مع البروم في الإيثانول ومع المحلول المائي ليوديد البوتاسيوم وفي كلتا الحالتين يتم الحصول على رباعي هاليد البيرول.
هذا وتتم هلجنة البيرولات التي تحمـل مجمـوعـات بديلة بالطريقة نفسها وبدون صعوبات، أما في تفاعله مع الكلور فيتم بطريقة غير مباشرة، ورابع كلوريد البيرول الناتج يتحلل مع الوقت.
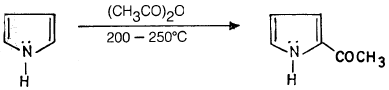
(4) أسيلة فريـدل – كرافتز Friedel – Crafts acylation of Pyrrole
– يعتبر البيرول نشطاً تجاه تفـاعـلات فريدل ـ كرافتـز فهو يقوم بالتفاعل مع حمض الخل اللامائي عند درجة حرارة (200 – 250°م) وبدون عامل مساعد ليعطي 2- استيل البيرول ( acetyl pyrrole-2) بالإضافة إلى قليل من 5,2ـ ثنائي أستيل البيرول.
– ومن الجدير بالذكر أن أسيلة البيرول تصبح أكثر سهولة كلما زاد عدد المجموعات الألكيلية على البيرول.
– كما أن هناك عدة طرق تستخدم لإدخال مجموعة الأسيل إلى حلقة البيرول منها:
(أ) استخدام معقـد كاشف جرينارد مع البيرول للتفاعل مع الأحماض اللامائية أو كلوريدات الأحماض.
(ب) استخدام تفاعل جترمان Gattermann Reaction حيث يستخدم سيانيد الهيدروجين.
– ومن جهة أخـرى يمكن أسيلة البيرول على ذرة النتروجين عن طريق تفاعل ملح Pyrro potassium مع كلوريدات الأحماض كما ذكر سابقاً أو عن طريق تفاعل البيرول نفسه مع –N أستيل الأميدازول کما تبين المعادلة التالية:
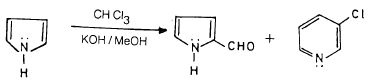
(5) تفاعل ريمر – تيمان Reimer–Tiemann reaction
-عندما يغلي البيرول مع الكلوروفورم وهيدروكسيد البوتاسيوم الكحولي ينتج خليط من بيرول 2- الدهيد و3- كلوريد البيريدين. والمادة المتفاعلة عبارة عن ثنائي كلوريد الكاربین کما تبين المعادلة التالية:
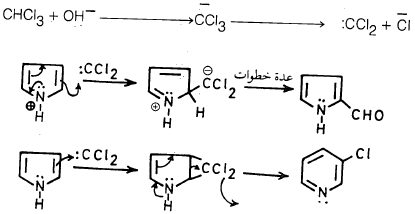
– أما ميكانيكية هذا التفاعل فهي تتم وفقاً للخطوات التالية:
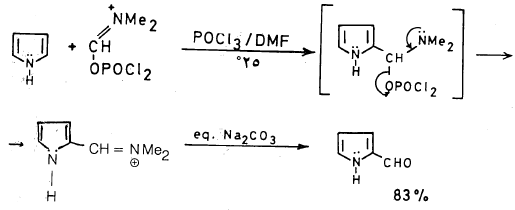
– ويمكن تحضير بيرول 2- الدهيد بحصيلة مرتفعة تصل إلى 90٪ وذلك بطريقة فلزمير کما تبين المعادلة التالية:
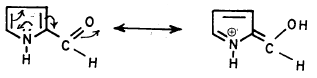
– ومن الجدير بالذكر أن بيرول 2- الدهيد لا يقوم بالتفاعلات التي يقوم بها البنزالدهيد وذلك بسبب أن مجموعة الكربونيل يتم تثبيطها من خلال عملية التأرجح (الرنين) التالية:
الخلاصة
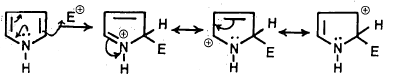
ومن الملاحظ أن جميع تفاعلات الاستبدال الإلكتروفيلية تفضل موضع 2- بصورة رئيسة ثم موضع 3- بصورة أقل أو عندما يكون موضع 2ـ مشغولاً.
والسبب في ذلك يتضح إذا نظرنا إلى التراكيب التأرجحية (التراكيب الرنينية) لمشتق البيرول عند الإضافة إلى موضع 2- وموضع 3-.
أولاً/ عند الإضافة إلى موضع ٢- نحصل على التراكيب التأرجحية التالية:
ثانياً/ عند الإضافة إلى موضع 3- نحصل على التراكيب التأرجحية التالية:
ومن ذلك يتضح أن الإضافة إلى موضع 2- تعطي مركباً أكثر ثباتاً من الإضافة إلى موضع 3- لوجود ثلاثة أشكال تأرجحية في حالة الإضافة إلى موضع ٢- بينما يوجد شکلان تأرجحيان فقط عند الإضافة إلى موضع 3- .
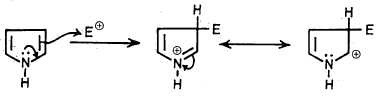
وهذا هو ملخص تفاعلات الأستبدال النيكلوفيلية على الموضع (2) للبيرول:
المراجع:
- كتاب المركبات الحلقية غير المتجانسة والحيوية للدكتور حمد بن عبدالله اللحيدان والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب – الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية
- محاضرات 341 كيم كيمياء المركبات الحلقية غير المتجانسة Chemistry of Heterocyclic Compounds للدكتور عبدالله بن محمد الماجد – جامعة الملك سعود – السعودية
- كتاب الكيمياء العضوية للمؤلف د.حسن محمد الحازمي / الجزء الثاني