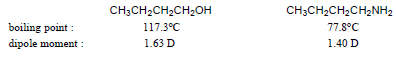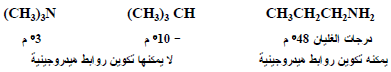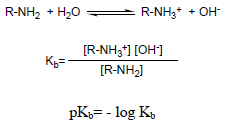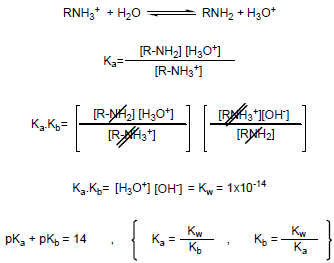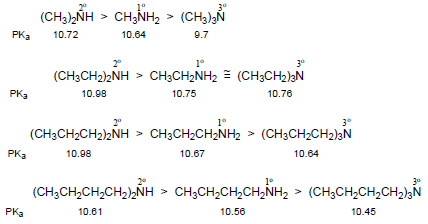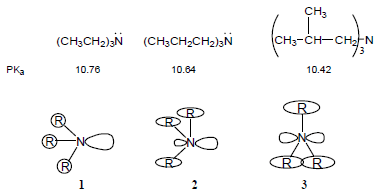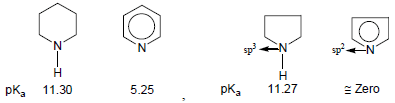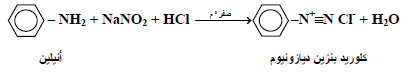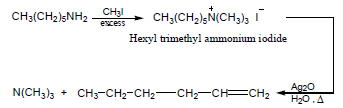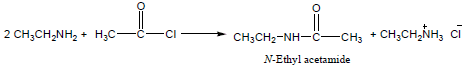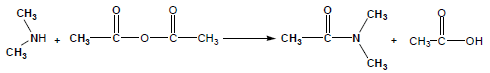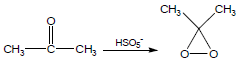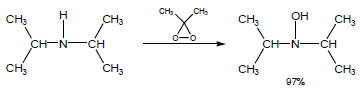الخواص الفيزيائية والكيميائية للأمينات Amines
في هذا الموضوع سوف نشرح الخواص الفيزيائية والكيميائية للأمينات Physical and Chemical properties of Amines
الخواص الفيزيائية والكيميائية للأمينات Physical and Chemical properties of Amines
أن شاء سوف نشرح في هذا الموضوع الخواص الفيزيائية والكيميائية للأمينات Physical and Chemical properties of Amines سوف نتناول العناصر الأتية:
أولاً/ الخواص الفيزيائية للأمينات Physical properties of Amines
(1) درجة الغليان للأمينات Boiling point of Amines
(2) الذوبانية Solubility of Amines
(3) الرائحة Odor of Amines
ثانياً/ الخواص الكيميائية للأمينات Chemical properties of Amines
(1) قاعدية الأمينات Basicity of Amines
(2) تفاعل الأمينات مع حمض النيتروز
(3) تفاعل تكوين الأملاح Salt formation
(4) تفاعل الأمينات مع كلوريدات الأحماض
(5) تفاعل الأمينات مع أنهيدريدات الأحماض
(6) أكسدة الأمينات Oxidation of Amines
(7) تفاعل الأمينات مع الأيزوسيانيت
(8) اختبار هينزبرغ Hinsberg,s test
(9) تفاعلات الأنيلين Reactions of Aniline
فلنبدأ على بركة الله بشرح الخواص الفيزيائية والكيميائية للأمينات
أولاً/ الخواص الفيزيائية للأمينات Physical of Amines
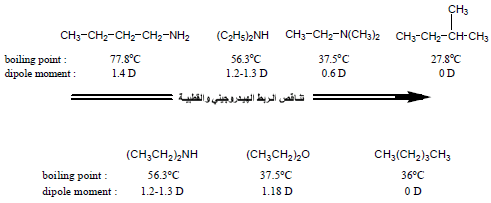
(1) درجة الغليان للأمينات Boiling point of Amines
– للأمينات درجات غليان أعلى من درجات غليان الألكانات والإيثرات المقابلة لها في الوزن الجزيئي وذلك بسبب مقدرة الأمينات الأولية والثانوية على تكوين روابط هيدروجينية بين جزيئاتها بالإضافة إلى قطبية جزيئاتها.
– وللأمينات درجات غليان أقل من درجات غليان الكحولات المقابلة لها في الوزن الجزيئي وذلك بسبب مقدرة الكحولات على تكوين روابط هيدروجينية أقوى من التي تكونها الأمينات لأن الكحولات أكثر حمضية من الأمينات.
– لما كانت الأمينات الثالثية لا تحتوي على رابطة -NH فأنها سوف لا تستطيع أن تكون روابط هيدروجينية بينية في حالتها السائلة النقية ، وعلى هذا الأساس فأن الأمينات الثالثية تمتلك درجات غليان أقل من مثيلاتها الأولية والثانوية.
– الأمينات الثالثية تكون درجات غليانها مقاربة لدرجات غليان الألكينات ذات الأوزان الجزيئية المقاربة لها مثلاً:
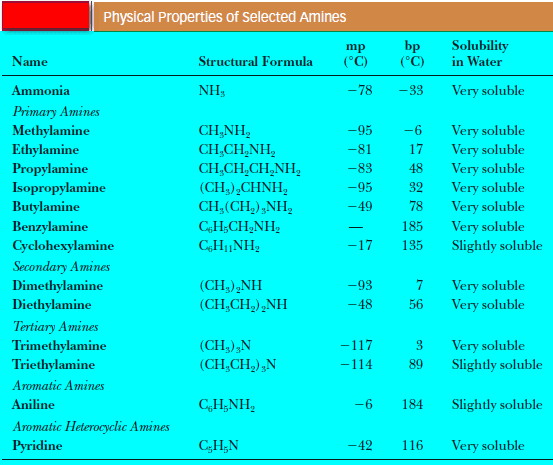
– الجدول التالي يوضح درجات الانصهار والغليان والذوبانية في الماء للأمينات الأولية والثانوية والثالثية:
(2) الذوبانية Solubility of Amines
– تذوب جميع الأمينات ، والتي تملك الأوزان الجزيئية القليلة الماء ويعود ذ لك إلى قدرتها على تكوين روابط هيدروجينية مع الماء . ويمكن للأمينات الثالثية والأولية والثانوية أن تكون مثل هذه الروابط مع الماء.
– ويرجع ذلك لاحتوائها جميعاً على زوج من الإلكترونات غير المشتركة الذي يستخدم في تكوين الروابط الهيدروجينية مع الماء.
– لقد وجد أن قابلية ذوبان الأمينات في الماء تقل كلما زاد عدد ذرات الكربون . كذلك فأن الأمينات تذوب في المذيبات الأقل قطبية كالأيثر والكحول والبنزين.
– تذوب الأمينات منخفضة الوزن الجزيئي بسهولة في الماء وتقل الذوبانية بزيادة الوزن الجزيئي.
(3) الرائحة Odor of Amines
– تمتاز الأمينات الطيارة بأن لها روائح مزعجة مميزة فمثلاً للميثيل أمين رائحة تشبه رائحة الأمونيا ، ولثلاثي مي ثيل أمين رائحة مشابهة لرائحة سمك السلامون ، بينما للبيريدين رائحة مشابهة لرائحة الأسماك الميتة والتي تعيش في المياه العذبة.
– لا تمتلك الأمينات الأريلية روائح غير مرغوب فيها مماثلة للأمينات الألكيلية ، إلا أنها جميعاً تعتبر مواد سامة ولها تأثيرات بيولوجية كونها تمتص من خلال الجلد . كما أن بعضها يعد مواد تسبب السرطان ، مثل بيتا – نفثيل أمين.
– تسلك أملاح الأمينات وأملاح الأمونيوم الرباعية سلوكاً يشبه الأملاح غير العضوية ، فجميعها عديمة الرائحة ، ذات درجات انصهار عالية ، وتذوب في الماء.
ثانياً/ الخواص الكيميائية للأمينات Chemical properties of Amines
أولاً: قاعدية الأمينات Basicity of Amines
– أن زوج الإلكترونات غير الرابط على ذرة النيتروجين هو المتحكم في معظم الخواص الكيميائية للأمينات لأنه يعمل كقاعدة وكنيوكلوفيل.
– تعتبر قاعدية الأمينات أعلى بكثير من قاعدية الكحولات والإيثرات والماء.
– يستخدم ثابت تأين القاعدة كمقياس للقاعدية basicity constant Kb فعند ذوبان الأمين في الماء يحدث الاتزان التالي:
– كلما زادت قيمة Kb ( قلت قيمة pKb) زادت قابلية الارتباط بالبروتون وبالتالي تزيد القاعدية.
– في حالة عدم معرفة قيم Kb أو pKb يمكن استنتاجها من حمضية ammonium ion RNH3+ كما يلي:
– من المعادلات السابقة نستنتج أن:
(1) عندما تكون Ka كبيرة تكون حمضية أيون الأمونيوم عالية.
(2) عندما تكون قيمة Ka صغيرة pKa) كبيرة) تكون القاعدية عالية.
– تختلف قاعدية الأمينات باختلاف المجموعات المرتبطة بذرة النيتروجين فنجد أن الأمينات الأليفاتية أكثر قاعدية من الأمونيا والأمينات الآروماتية أقل قاعدية من الأمونيا والسبب في ذلك هو مجموعة الألكيل الدافعة للإلكترونات تعمل على زيادة الشحنة السالبة على ذرة النيتروجين فتزيد من قدرتها على الارتباط بالبروتون.
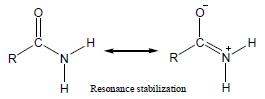
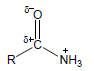
– عند مقارنة قاعدية الأمينات مع قاعدية الأميدات نجد أن للأمينات قاعدية أعلى من قاعدية الأميدات وذلك بسبب توزيع الشحنة السالبة الناتج عن الرنين في جزئ الأميد.
– عند ارتباط الأميد بالبروتون لا يصبح للجزئ استقرار رنيني وبالتالي يكون أقل استقراراً بسبب عدم توزيع الشحنة الموجبة.
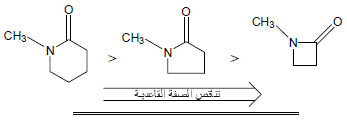
– في اللاكتامات Lactams كلما صغر حجم الحلقة كلما قلت القاعدية وذلك بسبب تأثير يعرف بتأثير الإجهاد الداخلي Internal strain ويكتب مختصراً I-strain حيث يؤدي صغر حجم الحلقة إلى نقص الزوايا الداخلية الذي يسبب تناقص صفة (s) للذرات المكونة للحلقة وبالتالي تقل كهروسالبيتها.
أما بالنسبة لذرة كربون مجموعة الكربونيل فهى تحتوي على صفة (s) أعلى وبالتالي تكون أقل كهروسالبية ولهذا فأن مجموعة الكربونيل في المركبات الحلقية الصغيرة تكون أقل قاعدية.
قاعدية الأمينات الأليفاتية Basicity of Aliphatic amines
(1) تكون قاعدية Methyl amines في الطور الغازي متزايدة بانتظام كما يلي:
(2) تختلف قاعدية الأمينات في المحاليل المائية عن الطور الغازي حيث نجد أن للأمينات الثانوية قاعدية أعلى من الأمينات الأولية والتي بدورها تكون أعلى من قاعدية الأمونيا وذلك لأنها تعتمد على الكثافة الإلكترونية على ذرة النيتروجين.
(3) في المحاليل المائية تكون قاعدية ثلاثي ألكيل أمين أضعف أو مساوية للأمين الأولي وذلك لأنها لا تعتمد على الكثافة الإلكترونية على ذرة النيتروجين بل تعتمد على تأثير المحلول حيث تميل المجموعات البديلة لاحتلال أحجام أكبر بسبب دورانها العشوائي فتؤثر الإعاقة المجسامية التي تسببها على ثبات ناتج الإضافة بين الحمض والقاعدة وهذا التأثير يعرف بالأجهاد الأمامي Front strain ويكتب مختصراً F-strain
(قيم pKa الموضحة أدناه هي للحمض المرافق)
(4) تقل قاعدية الأمينات بزيادة حجم مجموعات الألكيل وذلك بسبب تأثير يعرف بتأثير الإجهاد الخلفي Back-strain ويكتب مختصراً B-strain فعندما تكون مجموعات الألكيل على ذرة النيتروجين كبيرة جداً في الحجم فأنها تعمل على اتساع زاوية الأمين مسببة بذلك زيادة استعمال صفة فلك (s) في هذه الروابط وزيادة صفة فلك (p) لزوج الإلكترونات غير الرابط.
الإجهاد الخلفي في الأمينات ثلاثية الألكيل
(أ) عندما تكون مجموعات الألكيل صغيرة الحجم لا يكون هناك إجهاد خلفي وتكون القاعدية عالية (شكل رقم (1
(ب) (في الشكل رقم 2) مجموعات ألكيل متوسطة الحجم وإجهاد خلفي متوسط.
(جـ) عندما تصل مجموعات الألكيل كبيرة الحجم إلى الحد الأعلى من الحجم تجعل ذرة النيتروجين تأخذ الوضع المستوي وتصبح ذات تهجين p+sp2 وتسبب ضعف القاعدية.
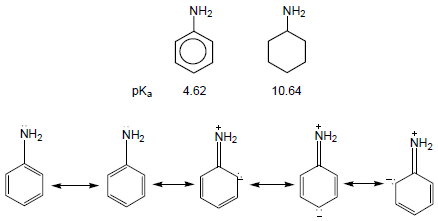
قاعدية الأمينات الآروماتية Basicity of Aromatic amines
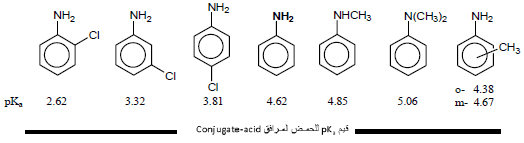
– أن قاعدية الأمينات الآروماتية أقل بكثير من قاعدية الأمينات الإليفاتية حيث يتضح ذلك من خلال مقارنة aniline مع cyclohexyle amine ، يسبب الرنين في جزئ Aniline إلى عدم تمركز زوج الإلكترونات على ذرة النيتروجين فتقل قدرة ارتباطه بالبروتون فتقل القاعدية.
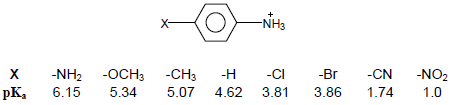
– تزداد قاعدية Aniline بوجود المجموعات الدافعة للإلكترونات وتقل بوجود المجموعات الساحبة للإلكترونات.
أمثلة:
– الجدول التالي يوضح بعض قيم pKa لأيونات Anilinium
قاعدية الأمينات الحلقية غير المتجانسة
– تزداد كهروسالبية ذرة النيتروجين بزيادة صفة فلك (s) في التهجين وكلما زادت كهروسالبية ذرة النيتروجين كلما قلت فاعليتها وذلك بسبب المشاركة بزوج الإلكترونات غير الرابط وبالتالي تقل القاعدية.
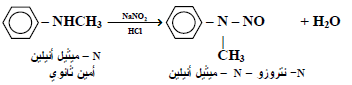
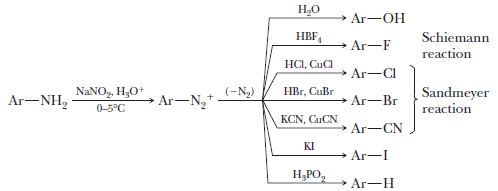
ثانياً: تفاعل الأمينات مع حمض النيتروز
The reaction between Amines and Nitrous acid
– لقد وجد أن الأمينات بأنواعها المختلفة ( اليفاتية أو أروماتية ) يمكنها التفاعل مع حمض النيتروز: الذي يحضر آنياً من تفاعل حامض الهيدروكلوريك مع نترايت الصوديوم . لتعطي نواتج معتمدة على نوع الأمين المتفاعل.
– فمثلاً يتفاعل الأنيلين والأمينات الأروماتية الأخرى مع حامض النيتروز البارد وفي محلول حامض الهيدروكلوريك لتكون كلوريدات أريل ديازونيوم (ArN2+Cl–) أو أملاح الديازونيوم.
– وهذه الأملاح فعالة جداً لذلك يجب إجراء التفاعل مع التبريد عند ظروف 0 Co تقريباً (املاح ألكيل ديازونيوم (RN2+Cl–) وكما سنرى فعالة جداً بحيث أنها تكون غير مستقرة حتى في الظروف الباردة كما يلي:
– وترجع الفعالية العالية لهذه الأملاح إلى الميل العالي لطرد غاز النيتروجين N2 لهذا فأنه يمكن استبدال مجموعة الديتزونيوم بنيوكليوفيلات مختلفة مثل I–.
– الأمينات الالكيلية الأولية تتفاعل مع نتريت الصوديوم وحامض الهيدروكلوريك لتعطي ملح الديازونيوم الالكيلي.
– تتفاعل الأمينات الثانوية ، اليفاتية كانت أم اروماتية مع حامض النيتروز لتعطي مركبات –N نتروز أمينات وهى مركبات تحتوي على مجموعة -N-N=O ولقد وجد أن العديد من هذه المركبات هي مركبات مشجعة لتكوين السرطان كما يلي:
– الشكل التالي يوضح ميكانيكية تفاعل الأمينات الأولية مع حمض النيتروز
Mechanism of reaction of primary Amine with Nitrous Acid
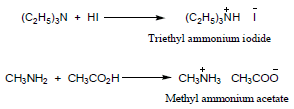
ثالثاً: تفاعل تكوين الأملاح Salt formation
– تتفاعل الأمينات مع الأحماض وتكون أملاح الأمونيوم الرباعية.
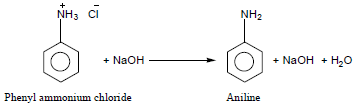
– تتفاعل أملاح الأمونيوم الرباعية مع القواعد فتتحرر الأمينات من أملاحها لأنها أقل قاعدية.
ملاحظات هامة
(1) جميع الأمينات التي لا تذوب في الماء تذوب في المحاليل المائية لــHCl, HBr, HI, H2SO4 لأنها تكون أملاح أمونيوم تذوب في الماء.
(2) الأميدات التي لا تذوب في الماء لا تذوب في المحاليل المائية لهذه الأحماض لأنها قواعد ضعيفة مقارنة بالأمينات.
(3) عند معالجة ملح الأمونيوم الرباعي بأكسيد الفضة المائي Ag2O مع التسخين يتكون أمين ثالثي وألكين كما يلي:
يكون ناتج الحذف الرئيسي في هذا التفاعل هو الألكين الأقل استبدالاً لأن الحذف من على الأهداف المشحونة يتبع قاعدة هوفمان.
رابعاً: تفاعل الأمينات مع كلوريدات الأحماض
Reaction between Amines and Acid Chlorides
يتم فيه أحلال مجموعة Acyl محل هيدروجين الأمين (أسيلة الأمين) وهو تحضير للأميدات.
خامساً: تفاعل الأمينات مع أنهيدريدات الأحماض
Reaction between Amines and Acid anhydrides
هو تفاعل لتحضير كل من الأميدات والأحماض الكربوكسيلية.
سادساً: أكسدة الأمينات Oxidation of Amines
(1) أكسدة الأمينات بواسطة dimethyl dioxirane
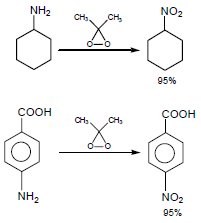
يستخدم المركب dimethyl dioxirane في أكسدة الأمينات والذي يحضر عن طريق اكسدة الاسيتون كما يلي:
حيث يتفاعل مع الأمينات الأولية والأروماتية ويحولها إلى مجموعة نيترو كما يلي:
ويتفاعل مع الأمينات الثانوية ويحولها إلى مجموعة hydroxyl amine كما يلي:
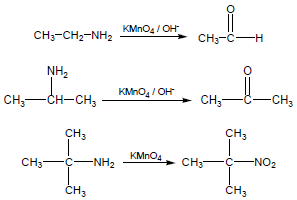
(2) أكسدة الأمينات بإستخدام برمنجانات البوتاسيوم
– عند أكسدة الأمينات باستخدام برمنجانات البوتاسيوم فأن الأمينات الأولية تتأكسد إلى ألدهيدات أو كيتونات أو تتأكسد مجموعة الأمين إلى مجموعة نيترو وذلك على حسب المجموعة العضوية
المرتبطة بمجموعة الأمين والتفاعلات التالية توضح ذلك:
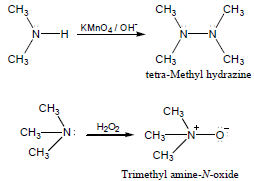
– تتأكسد الأمينات الثانوية إلى tert-alkyl لمشتقات hydrazine بينما تتفاعل الأمينات الثالثية ببطء ويمكن تحويلها إلى amine oxides باستخدام H2O2 كما يتضح من المعادلات الآتية:
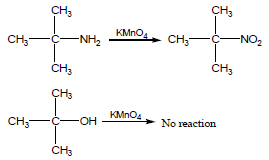
سؤال: كيف تميز بين المركبين التاليين بتفاعل كيميائي ؟
tert-Butyl alcohol , tert-Butyl amine
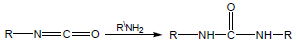
سابعاً: تفاعل الأمينات مع الأيزوسيانيت
Reaction between Amines and Isocyanate
تتفاعل الأمينات مع Isocyanate وينتج مشتقات اليوريا.
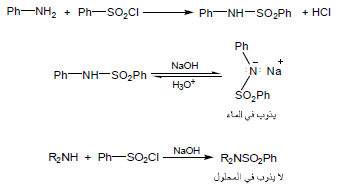
ثامناً: اختبار هينزبرغ Hinsberg,s test
اختبار هينزبرغ هو عبارة عن اختبار يستخدم للتمييز بين أنواع الأمينات حيث تتفاعل الأمينات الأولية والثانوية مع sulfonyl chloride (-SO2Cl) ويتكون sulfonamides مستبدلة على النيتروجين وعند معالجتها بمحلول هيدروكسيد الصوديوم يحدث الآتي:
(أ) في حالة الأمينات الأولية: يذوب الأميد الأولي الناتج مكوناً ملح صوديوم.
(ب) في حالة الأمينات الثانوية: الأميد الثانوي الناتج لا يذوب ويتكون راسب في المحلول
(جـ) في حالة الأمينات الثالثية: لا يحدث تفاعل لعدم وجود ذرة هيدروجين مرتبطة بذرة النيتروجين.
تاسعاً: تفاعلات الأنيلين Reactions of Aniline
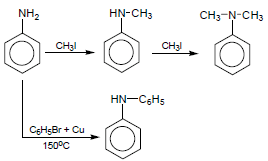
(1) تفاعل الأنيلين مع هاليد الألكيل
تتفاعل الأنيلين مع هاليد الألكيل وينتج أمينات ثانوية وثالثية كما يلى:-
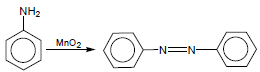
(2) تفاعل الأنيلين مع ثاني أكسيد المنجنيز
يتفاعل الأنيلين مع ثاني أكسيد المنجنيز MnO2 ويتحول إلى Azobenzen كما يلى:
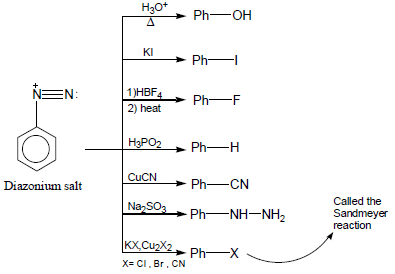
(3) تفاعل تكوين الديازونيوم Diazotization
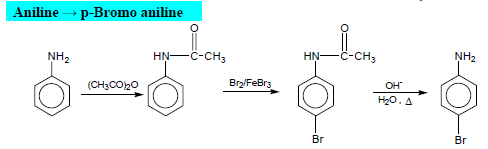
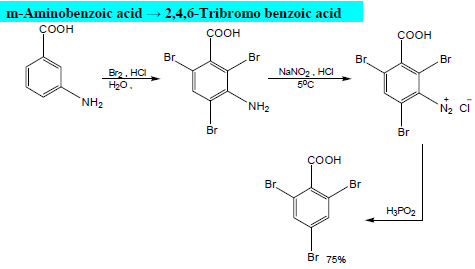
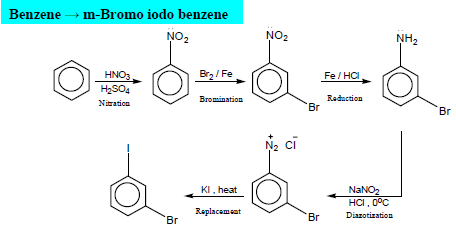
من التفاعلات الهامة للأنيلين هو تفاعل تكوين الديازونيوم Diazotization الذي يمكن ان يتحول غلى عديد من المشتقات الأروماتية كما يلي:
أو من الممكن على هذة الصورة:
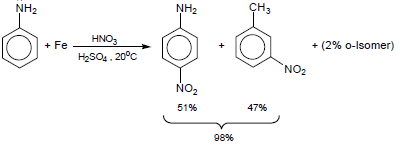
(4) نيترة الأنيلين Nitration of Aniline
– عملية نيترة الأنيلين هى تفاعل إحلال إلكتروفيلي.
– عند استخدام حمض لويس قوي وملركز لنيترة الأنيلين فإن مجموعة الأمين يحدث لها عملية برتنة وبذلك يفقد النيتروجين زوج الإلكترونات غير الرابط ويتكون ملح الأمونيوم (-NH3+) فيصبح التوجيه كما يلي:
كيف تجري التحويلات الأتية:
وبفضل الله قد تم شرح موضوع الخواص الفيزيائية والكيميائية للأمينات وإذا كان لديك أى سؤال فلا تردد بترك تعليق وسوف نجيب عليك فى أقرب وقت ممكن
المراجع :
– أساسيات الكيمياء العضوية/ محمد مجدي واصل/ جامعة الأزهر – جمهورية مصر العربية
Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak / sixth edition/ United States