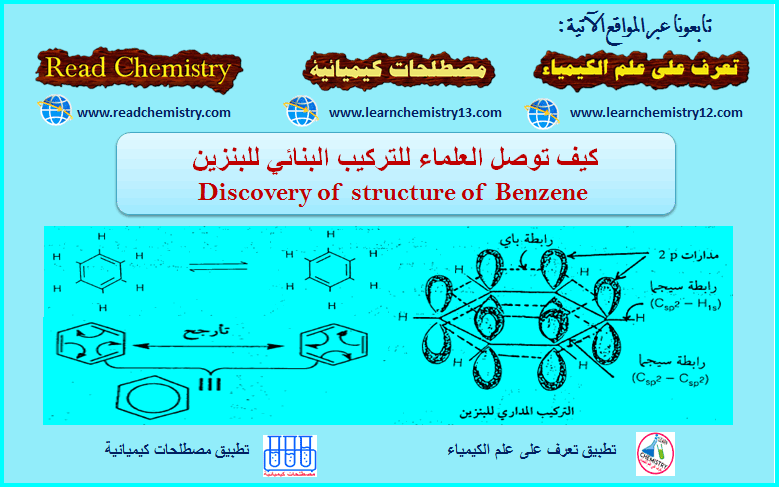
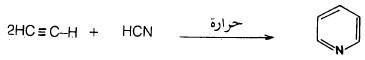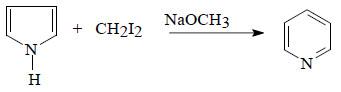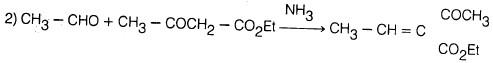البريدين Pyridine ( طرق تحضير البريدين – الخواص الفيزيائية)
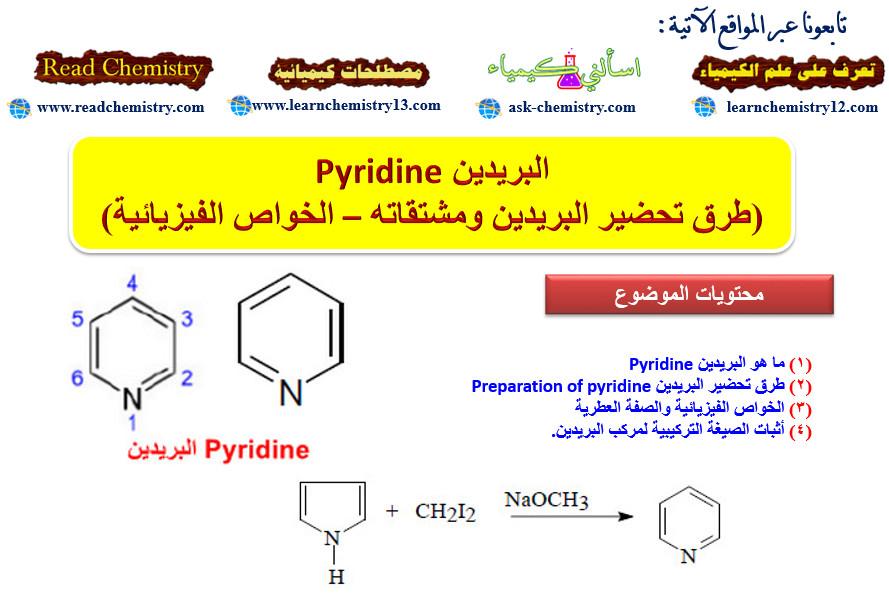
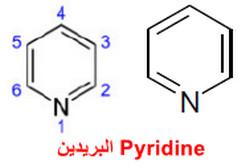
ما هو مركب البريدين Pyridine؟
– البريدين هو مركب أروماتي عطري يتكون من حلقة سداسية تشبه البنزين تحتوي على ذرة واحدة غير متجانسة وهي ذرة النيتروجين.
– التركيب الكيميائي له كما بالشكل التالي:
– تم التعرف على هذا المركب، وعزله في منتصف القرن التاسع عشر وقد حضر البريدين بصورة نقية من زيت العظام وقطران الفحم.
– كما أن المركبات التي تحتوي على حلقة البريدين منتشرة بصورة واسعة في الطبيعة، ومن أمثلة هذه المركبات فيتامين ب6 (B6) بالإضافة إلى وجوده في عدد كبير من الأدوية والأصباغ والقلويدات.
– ومن المعروف أن البريدين مركب عطري وهو يشبه البنزين إلى أبعد الحدود إلا أنه أقل طاقة تأرجحية وأقل استقرارا تجاه بعض التفاعلات الكيميائية.
– بالإضافة إلى أن عدد متشكلات البريدين أكثر من تلك التي للبنزين. وتعرف الكاتيونات التي تشتق من البريدين بالبريدنيوم (Pyridinium).
طرق تحضير البريدين Preparation of pyridine
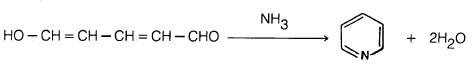
(1) من الدهيد الجلوناكوتيك والأمونيا
يمكن تحضير البريدين من الدهيد الجلوناكوتيك والأمونيا إلا أن مثل هذه الطريقة ليست ذات أهمية كبيرة من الناحية العملية.
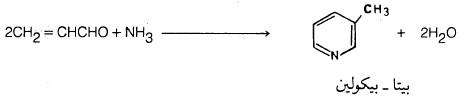
كذلك هناك عدد كبير من الألدهيدات والكيتونات يمكن أن تتفاعل مع الأمونيا وتعطي البريدين إلا أنها تعطي خليطا من النواتج. ومن الأمثلة على ذلك:
(2) من الأسيتيلين وسيانيد الهيدوجين
يمكن تحضير البريدين عن طريق إمـرار خليط من الإستلين وسيانيد الهيدروجين من خلال أنبوب ساخن.
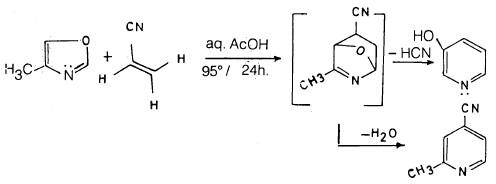
(3) تفاعل دييلز – الدر Diels – Alder reaction
يمكن أن يحضر البريدين بطريقة دييلز – الدر حيث يمكن أن يتفاعل الأوكسازول مع مركب يحتوي على رابطة مضاعفة نشطة مثل سيانو إثيلين كما تبين ذلك المعادلات التالية:
(4) تسخين البيرول مع أيويد المثيلين
يتم تحضير البريدين من تسخين البيرول مع ايوديد الميثيلين methylene iodide وميثوكسيد الصوديوم عند درجة حرارة 200 مo.
أما مشتقات البريدين فيمكن أن تحضر بعدة طرق من أهمها:
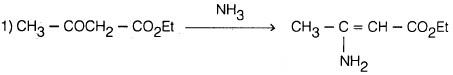
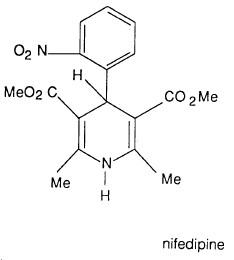
(5) طريقة هانتزش Hantzsch synthesis
حيث يؤخذ جزيئان من مركب ثنائي المجموعة الكربونيلية ويتكاثفان مع جزيء من أستالدهيد وجزيء من الأمونيا حيث يتم الحصول على ثنائي هيدروبريدين وهذا يعطي مشتق البريدين بأكسدته بحمض النيتريك.
– والمعادلات التالية توضح خطوات هذا التفاعل.
وبمفاعلة الناتج في خطوة (1) مع ناتج خطوة (2) نحصل على:
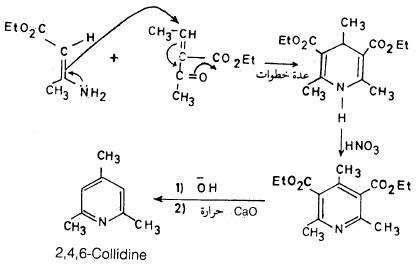
وطريقة هانتزش استخدمت حديثاً لتحضير نواتج لها خواص طبية مفيدة مثل عقار Nifedipine الذي له الصيغة التالية:
الخواص الفيزيائية والصفة العطرية
- سائل عديم اللون.
- له القدرة على امتصاص الماء (Hygroscopic)
- يغلي عند 115 مo
- كما أن له رائحة مميزة وكريهة.
- يذوب في أغلب المذيبات العضوية وهو يستعمل كمذيب لكثير من المركبات العضوية.
- يمكن تجفيفه بصورة عامة بواسطة أكسيد الباريوم.
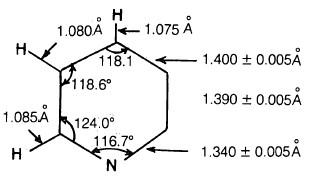
أثبات الصيغة التركيبية لمركب البريدين.
– بصورة عامة فإن الحسابات قد أظهرت أن للبريدين الأبعاد الموضحة كالتالي:
– كما أثبتت الدراسات المختلفة أن له الصفات الآتية:
(1) أطـوال الروابط كما هو واضح من الشكل السابق هي وسط بين أطوال الروابط الأحادية وأطوال الروابط الثنائية سواء بين الكربون والكربون أو بين الكربون والنتروجين.
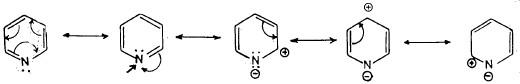
(2) البريدين له عدد من الصيغ التأرجحية تساهم في استقرار المركب ولذلك فهو عبارة عن هجين تأرجحي له طاقة تأرجحية تقدر بحوالي ٣٢ ك سعر / جزيء وهذا يعني أن له صفة أروماتية قوية، والصيغة التأرجحية يمكن أن تمثل كما يلي:
(3) حيث إن ذرة النتروجين ذات كهروسالبية عالية فإنه من المتوقع أن تحظى بكثافة إلكترونية عالية وهذا ما أثبتته حسابات الكثافة الإلكترونية وهذا يتم على حساب الكثافة الإلكترونية في كل من موضعي 2ـ و 4 ـ بصورة رئيسة وأقل من ذلك على حساب موضعي 3- و 5- . كما هو واضح من الصيغ التأرجحية السابقة.
(4) حيث إن ذرة النتروجين يوجد بها ثلاثة مدارات من نوع sp2 ومدار واحد من نوع (P) فإنها ترتبط بكل من ذرتي الكربون المجاورة لها بواسطة مدار sp2 وتكون رابطة (π)عن طريق تراكب مدار (P) في النتروجين مع مدار P في الكربون أما مدار sp2 ن الثالث فإنه يحتوي على زوج الإلكترونات الحرة وهذا يعني أن زوج الإلكترونات الحر لا يدخل في تكوين السحابة الإلكترونية للبريدين على عكس ما هو في البيرول.
المراجع:
- كتاب المركبات الحلقية غير المتجانسة والحيوية. للدكتور حمد بن عبدالله اللحيدان والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب. الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية
- محاضرات 341 كيم كيمياء المركبات الحلقية غير المتجانسة Chemistry of Heterocyclic Compounds. للدكتور عبدالله بن محمد الماجد – جامعة الملك سعود – السعودية
- كتاب الكيمياء العضوية للمؤلف د. حسن محمد الحازمي / الجزء الثاني