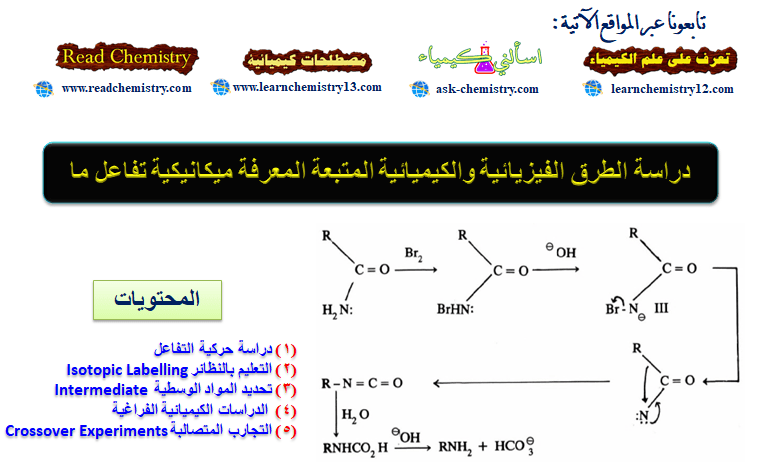
كيف توصل العلماء إلى التركيب البنائي للبنزين Benzene structure
البنزين والمركبات الآروماتية (العطرية)
– كان يطلق قديماً لفظ أروماتي (عطري) على تلك المركبات التي لها روائح عطرية مميزة خاصة مشتقات البنزين التي لها رائحة طيبة مثل الألدهيدات والإيثرات الأروماتية.
– لكن مع الزمن وبعد اكتشاف العديد من مشتقات البنزين التي لا رائحة لها، لم تعد هذه التسمية ذات معنى.
– وأصبحت المركبات الأروماتية تشمل كل المركبات الحلقية الأخرى التي تشابه البنزين في خواصه الكيميائية مقارنة بالألكينات (الأوليفينات).
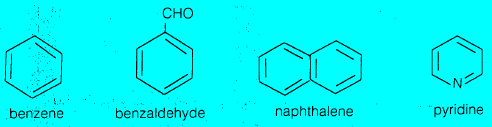
– من أمثلة المركبات الأروماتية البنزين Benzene ومشتقاته. والمركبات الأروماتية عديدة الحلقة مثل النفثالين. والمركبات الغير متجانسة مثل البيريدين.
مقارنة سريعة بين البنزين (المركبات الآروماتية) والألكينات
– يتضح من مقارنة الصيغة الكيميائية العامة للبنزين (CnH2n-6) أو الصيغ الكيميائية العامة للمركبات الأروماتية السابقة بشكل عام، بالصيغة الكيميائية العامة للألكينات (CnH2n) أن البنزين والمركبات الأروماتية الأخرى تفوق الألكينات في خاصية عدم التشبع.
– حيث تحتوى تلك المركبات الأورماتية على أكثر من رابطة مضاعفة. ومع ذلك لا تتفاعل بالإضافة كما في حالة الألكينات. حيث أنها لا تزيل لون البرومين ولا لون برمنجانات البوتاسيوم.
– وإنما تتفاعل عن طريق الاستبدال بدلاً من الإضافة. وذلك راجع إلى ثبات الروابط المضاعفة في البنزين Benzene والمركبات الأروماتية الأخرى مقارنة بالألكينات كما سيتضح فيما بعد.
اقتراح كيكولي لتركيب جزئ البنزين Kekule’s Proposal
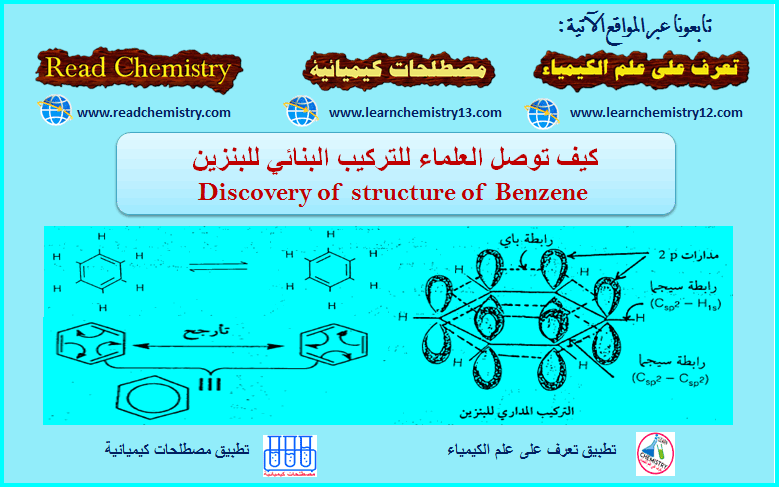
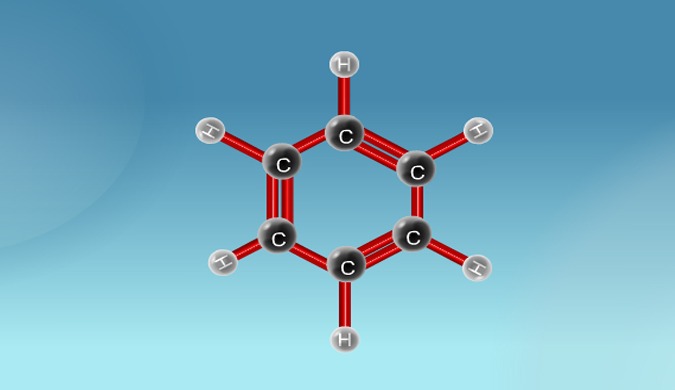
– لقد اقترح العالم كيكولي 1865م أن البنزين Benzene عبارة عن حلقة سداسية الأضلاع، تتكون من ست ذرات كربون، وست ذرات هيدروجين كل واحدة من ذرات الهيدروجين متصلة بذرة كربون.
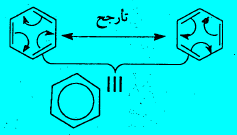
– اقترح كذلك أن البنزين Benzene يحتوى على ثلاث روابط مضاعفة لكى تنطبق القاعدة التي تنص على أن الكربون رباعي التكافؤ. وأن تلك الروابط المضاعفة تتحرك إلى الأمام وإلى الخلف بشكل سريع كى تكون الأشكال الآتية التي لا يمكن فصلها.
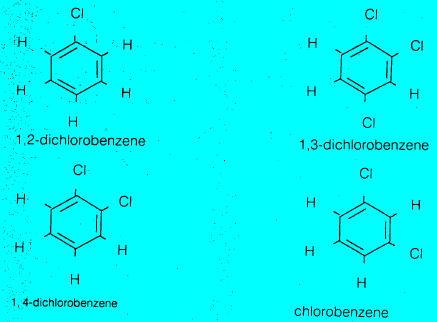
– هذا الاقتراح يفسر الحقيقة التي تنص على وجود مركب واحد فقط، لكلورو بنزين أي أنه لا يوجد متشابهات أخرى. كما أنه يوجد ثلاثة متشابهات فقط لثنائي كلوروبنزين. وهذا دليل على أن جميع ذرات الهيدروجين الستة متكافئة.
– بالرغم من أن اقتراح كيكولي منسجم مع كثير من نتائج التجارب الخاصة بالبنزين الإ أنه لم يحل المشكلة بشكل نهائي فيما يتعلق بالثبات الكيميائي غير العادي للبنزين مقارنة بالأوليفينات.
– فإذا كان البنزين Benzene يحتوى على ثلاث روابط مضاعفة كما اقترح كيكولي ، فإنه يجب أن يتفاعل مع البروم (Br2) كما لو كان أوليفين. ولكن في الواقع نجد أن البنزين إلى حد ما خامل تجاه البروم. لذلك فأن البنزين لا يمكن أن يكون لدية ثلاث روابطة مضاعفة كما هو مقترح.
التأرجح (الرنين) في حلقة البنزين Resonance
– تنص نظرية التأرجح (الرنين) على أنه:
كلما أمكن تمثيل مادة بشكلين (أو أكثر) متكافئين أو قريبين للتكافؤ في التركيب مختلفين فقط في موقع إلكترونات التكافؤ دون المساس بهيكل المجموعة، فأن الجزء الأصلي لا يمثل أياً منهما. ولكنه عبارة عن هجين تأرجحي لجميع الأشكال التأرجحية.
– بالرجوع إلي جزئ البنزين فإن الشكلين السابقين لجزيء البنزين لا يمثل أي منهما الجزيء. ولكن الشكل الحقيقي لجزئ البنزين عبارة عن هجين تأرجحي من هذين الشكلين. وبناء على أنه هجين فإن الروابط في كلا الشكلين تكون متساوية.
– لقد ثبت من القياسات الفيزيائية أن طول كل رابطة هو 1.40 أنجستروم. وهذه القيمة عددية متوسطة بين القيمة العددية التى تخص الرابطة الأحادية (1.54 أنجستروم) وبين القيمة العددية التي تخص الرابطة المضاعفة (1.34 أنجستروم).
– يمكن أن يعزى الثبات الزائد للبنزين عن الأوليفينات العادية إلى ظاهرة التأرجح (الرنين) هذه. ويكون الثبات الناشئ من التأرجح كبيراً لدرجة ان روابط الباي π-Bonds (الروابط المضاعفة) للجزيء تقاوم الكسر على عكس ما هو موجود في الأوليفينات.
المدارات الجزيئية Molecular orbitals
المدارات الجزيئية لجزئ البنزين تعطي صورة أوضح للرابطة المضاعفة في جزئ البنزين، نجد أن:
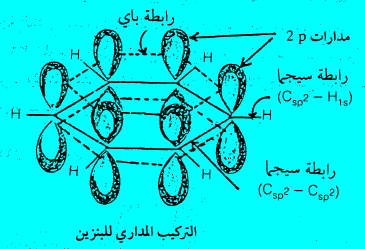
(1) ذرات حلقات البنزين تقع في مستوي واحد. وأنها مرتبطة مع بعضها على هيئة مسدس متساوي الأضلاع (زوايا 120o) بها كل الروابط الست بين ذرات الكربون بالطول نفسه (1.40 انجستروم).
(2) كل ذرة كربون مرتبطة بذرة هيدروجين وذرتي كربون بواسطة روابط يكون فيها تهجين الكربون من نوع sp2. أي أن ذرات الكربون الست مرتبطة بعضها مع بعض بشكل سداسي بروابط سيجما احادية تتكون بتداخل مدارات من نوع sp2 وكل ذرة كربون مرتبطة بذرة هيدروجين برابطة سيجما Sigma bond أخرى ناتجة من التداخل بين مداري 1s على ذرة الهيدروجين و sp2 على ذرة الكربون.
(3) بالإضافة إلى ذلك فإن كل ذرة كربون تحتوي على مدار 2p يحتوى على إلكترون واحد. والتداخل بين مدارات 2pالست يكون ثلاث روابط باي. وبسبب تماثل الجزيء فإن كلاً من مدارات 2p يمكن أن يكون رابطة مع أي من مدارات 2p في أي ذرتي كربون متجاورتين في جزئ البنزين. أي أن مدارات باي تكون لا موضعية.
وبالتالي فأن كثافة إلكترونات باي π-electrons تكون متماثلة تماماً حول الحلقة مكونة سحابة إلكترونية تمتد فوق وأسفل الحلقة. وتؤدي إلى ثبات الجزيء واستقرار الحلقة. وبناء على ذلك فإن الروابط بين ذرات الكربون لا تأخذ أبعاد أطوال الرابطة الأحادية أو المضاعفة. وإنما تكون أبعاد أطوال وسطية بين القيمة التي تخص الرابطة الأحادية والمضاعفة كما سبق وأن أوردنا.
طاقة التأرجح (طاقة الرنين) للبنزين The Resonance Energy of Benzene
– يخضع البنزين والمركبات الأروماتية الاخرى لتفاعلات الاستبدال بدلاً من تفاعلات الإضافة نظراً لثبات الروابط المضاعفة بسبب إلكترونات باي اللاموضعية أو بمعنى آخر بسبب التأرجح (الرنين).
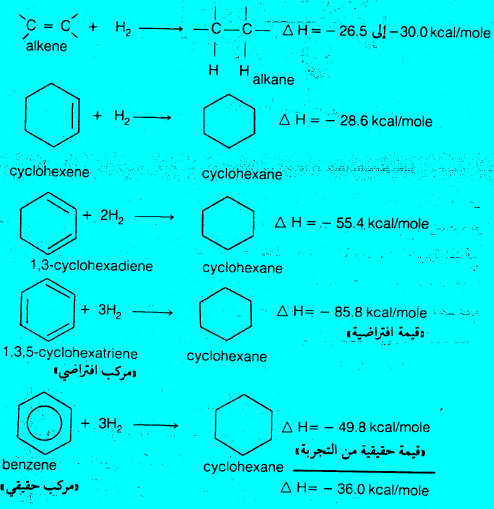
– لكى نوضح تلك الحقيقة السابقة نقارن بين الحرارة المتوقع انبعاثها نظرياً نتيجة لهدرجة جزئ البنزين وبين كمية الحرارة التي تنبعث فعلاً بالتجربة والناتجة من هدرجة جزئ البنزين.
– من المعروف أن هدرجة رابطة مضاعفة معزولة في مركب ما مفتوح تؤدي إلى انبعاث حرارة قيمتها من 26.5 إلى 30 كيلو سعر حراري لكل مول. وتفيد التجربة أن مقدار الحرارة المنبعثة عند هدرجة السيكلو هكسين هي 28.6 كيلو سعر حراري كل مول. في حين أن الحرارة المنبعثة عند هدرجة السيكلو هكسادائيين هي 55.4 كيلو سعر حرارى لكل مول. وهذه القيمة مضاعفة لتلك القيمة الناتجة من الحرارة المنبعثة عند هدرجة السيكلوهكسين.
– من البديهي أن نتوقع أن حرارة هدرجة البنزين تساوي ثلاثة أمثال حرارة هدرجة السيكلوهكسين طالما أن
حرارة أي رابطة مضاعفة تساوي 28.6 كيلو سعر حرارى لكل مول. بمعنى آخر أن تكون الحرارة المنبعثة عند هدرجة البنزين تساوي 85.8 كيلو سعر حرارى لكل مول. ولكن كمية حرارة هدرجة مركب له ثلاث روابط مضاعفة، كما هو الحال في المركب الافتراضي السيكلوهكساترائين وبين حرارة هدرجة البنزين يساوي 36 كيلو سعر حرارى لكل مول. أي أن البنزين أقل طاقة بمقدار 36 كيلو سعر حرارى لكل مول. وفارق الطاقة هذا هو المسئول عن ثبات حلقة البنزين.
– لما كان هذا الثبات ناشئاً عن ظاهرة التأرجح (الرنين) على حلقة البنزين فإن فارق الطاقة يعرف بطاقة التأرجح (طاقة الرنين).
– طاقة التأرجح (طاقة الرنين) = الفرق بين القيمة الحقيقية والقيمة الافتراضية لـــ ΔH
لماذا تخضع المركبات الآروماتية (البنزين) لتفاعلات الأستبدال وليس الإضافة؟
– يخضع البنزين والمركبات الأروماتية الاخرى لتفاعلات الاستبدال بدلاً من تفاعلات الإضافة. وذلك نظراً لثبات الروابط المضاعفة بسبب إلكترونات باي اللاموضعية أو بمعنى آخر بسبب التأرجح (الرنين).
– وبالتالي فإن الحلقة ذات الصيغة الأروماتية تخضع لتفاعلات الاستبدال حيث تحل مجموعة أو أكثر محل ذرة هيدروجين أو أكثر في الحلقة. وليس كما هو الحال في الاوليفينات والتي تخضع لتفاعلات الإضافة لأن تفاعلات الإضافة إن حدثت على حلقة البنزين تؤدي إلى تحطيم الصفة الأروماتية. وبالتالي فقد طاقة التأرجح التى تؤدي إلى استقرار البنزين.
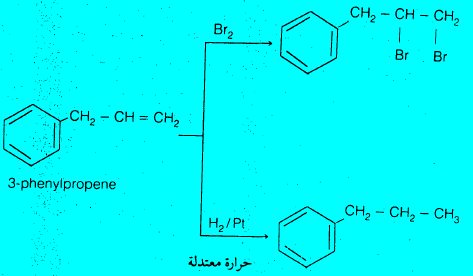
– مثلاً لو فاعلنا جزئ 3-فينيل بروبين والذي يحتوي على كل من جزئ البنزين وعلى أولفين، مع البروم (بدون عامل مساعد) أو مع الهيدروجين والبلاتين عند درجات حرارة عادية نجد أن الإضافة تحدث فقط على جزئ الأولفين دون المساس بحلقة البنزين مما يؤكد ثبات حلقة البنزين.
يمكنك مشاهدة هذا الفيديو الرائع عن : قصة أكتشاف البنزين (رابط الفيديو على يوتيوب)


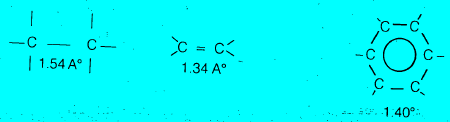




من اروع الموضوعات في الكيمياء وخاصة للمبتدئين ، مشكورين وربنا يعينكم
شكراً لك عزيزي
عاشت ايدكم. جزاكم الله خير