الكيمياء العضوية
قاعدية الأمينات Basicity of Amines

تعريف الأمينات Definition of Amines
– الأمينات هي مجموعة من مركبات النيتروجين العضوية والتي تعتبر مشتقة من الأمونيا باستبدال ذرة هيدروجين أو أكثر بمجموعة عضوية أو أكثر.
– الأمينات هي المركبات التي تتكون من استبدال متعاقب لذرات هيدروجين الأمونيا بمجاميع الكيلية حيث تنتج ثلاث أصناف مختلفة من الأمينات وهي الأولية والثانوية والثالثية.
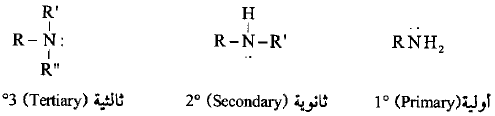
والتي تتميز بوجود مجموعة -NH2 أو مجموعة -NH ، وذرة النيتروجين الثالثية على التوالي.
قاعدية الأمينات Basicity of Amines
– أن زوج الإلكترونات غير الرابط على ذرة النيتروجين هو المتحكم في معظم الخواص الكيميائية للأمينات لأنه يعمل كقاعدة وكنيوكلوفيل.
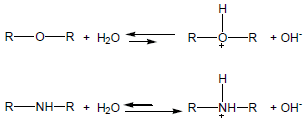
– تعتبر قاعدية الأمينات أعلى بكثير من قاعدية الكحولات والإيثرات والماء.
– يستخدم ثابت تأين القاعدة كمقياس للقاعدية basicity constant Kb فعند ذوبان الأمين في الماء يحدث الاتزان التالي:
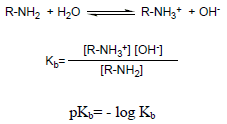
– كلما زادت قيمة Kb ( قلت قيمة pKb) زادت قابلية الارتباط بالبروتون وبالتالي تزيد القاعدية.
– في حالة عدم معرفة قيم Kb أو pKb يمكن استنتاجها من حمضية ammonium ion RNH3+ كما يلي:
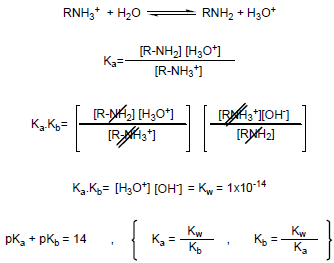
– من المعادلات السابقة نستنتج أن:
(1) عندما تكون Ka كبيرة تكون حمضية أيون الأمونيوم عالية.
(2) عندما تكون قيمة Ka صغيرة pKa) كبيرة) تكون القاعدية عالية.
– تختلف قاعدية الأمينات باختلاف المجموعات المرتبطة بذرة النيتروجين فنجد أن الأمينات الأليفاتية أكثر قاعدية من الأمونيا والأمينات الآروماتية أقل قاعدية من الأمونيا والسبب في ذلك هو مجموعة الألكيل الدافعة للإلكترونات تعمل على زيادة الشحنة السالبة على ذرة النيتروجين فتزيد من قدرتها على الارتباط بالبروتون.
– عند مقارنة قاعدية الأمينات مع قاعدية الأميدات نجد أن للأمينات قاعدية أعلى من قاعدية الأميدات وذلك بسبب توزيع الشحنة السالبة الناتج عن الرنين في جزئ الأميد.
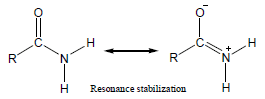
– عند ارتباط الأميد بالبروتون لا يصبح للجزئ استقرار رنيني وبالتالي يكون أقل استقراراً بسبب عدم توزيع الشحنة الموجبة.
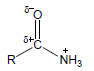
– في اللاكتامات Lactams كلما صغر حجم الحلقة كلما قلت القاعدية وذلك بسبب تأثير يعرف بتأثير الإجهاد الداخلي Internal strain ويكتب مختصراً I-strain حيث يؤدي صغر حجم الحلقة إلى نقص الزوايا الداخلية الذي يسبب تناقص صفة (s) للذرات المكونة للحلقة وبالتالي تقل كهروسالبيتها.
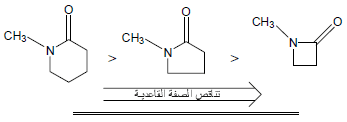
أما بالنسبة لذرة كربون مجموعة الكربونيل فهى تحتوي على صفة (s) أعلى وبالتالي تكون أقل كهروسالبية ولهذا فأن مجموعة الكربونيل في المركبات الحلقية الصغيرة تكون أقل قاعدية.
أولاً/ قاعدية الأمينات الأليفاتية Basicity of Aliphatic amines
(1) تكون قاعدية Methyl amines في الطور الغازي متزايدة بانتظام كما يلي:
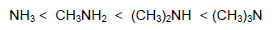
(2) تختلف قاعدية الأمينات في المحاليل المائية عن الطور الغازي حيث نجد أن للأمينات الثانوية قاعدية أعلى من الأمينات الأولية والتي بدورها تكون أعلى من قاعدية الأمونيا وذلك لأنها تعتمد على الكثافة الإلكترونية على ذرة النيتروجين.
(3) في المحاليل المائية تكون قاعدية ثلاثي ألكيل أمين أضعف أو مساوية للأمين الأولي وذلك لأنها لا تعتمد على الكثافة الإلكترونية على ذرة النيتروجين بل تعتمد على تأثير المحلول حيث تميل المجموعات البديلة لاحتلال أحجام أكبر بسبب دورانها العشوائي فتؤثر الإعاقة المجسامية التي تسببها على ثبات ناتج الإضافة بين الحمض والقاعدة وهذا التأثير يعرف بالأجهاد الأمامي Front strain ويكتب مختصراً F-strain
(قيم pKa الموضحة أدناه هي للحمض المرافق)
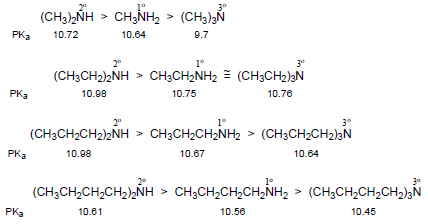
(4) تقل قاعدية الأمينات بزيادة حجم مجموعات الألكيل وذلك بسبب تأثير يعرف بتأثير الإجهاد الخلفي Back-strain ويكتب مختصراً B-strain فعندما تكون مجموعات الألكيل على ذرة النيتروجين كبيرة جداً في الحجم فأنها تعمل على اتساع زاوية الأمين مسببة بذلك زيادة استعمال صفة فلك (s) في هذه الروابط وزيادة صفة فلك (p) لزوج الإلكترونات غير الرابط.
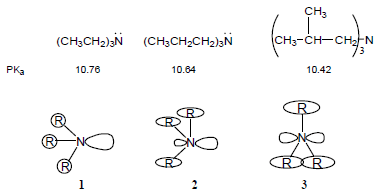
الإجهاد الخلفي في الأمينات ثلاثية الألكيل
(أ) عندما تكون مجموعات الألكيل صغيرة الحجم لا يكون هناك إجهاد خلفي وتكون القاعدية عالية (شكل رقم (1
(ب) (في الشكل رقم 2) مجموعات ألكيل متوسطة الحجم وإجهاد خلفي متوسط.
(جـ) عندما تصل مجموعات الألكيل كبيرة الحجم إلى الحد الأعلى من الحجم تجعل ذرة النيتروجين تأخذ الوضع المستوي وتصبح ذات تهجين p+sp2 وتسبب ضعف القاعدية.
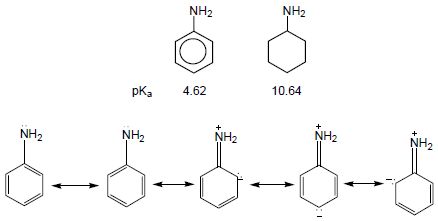
ثانياً/ قاعدية الأمينات الآروماتية Basicity of Aromatic amines
– أن قاعدية الأمينات الآروماتية أقل بكثير من قاعدية الأمينات الإليفاتية حيث يتضح ذلك من خلال مقارنة aniline مع cyclohexyle amine ، يسبب الرنين في جزئ Aniline إلى عدم تمركز زوج الإلكترونات على ذرة النيتروجين فتقل قدرة ارتباطه بالبروتون فتقل القاعدية.
– تزداد قاعدية Aniline بوجود المجموعات الدافعة للإلكترونات وتقل بوجود المجموعات الساحبة للإلكترونات.
أمثلة:
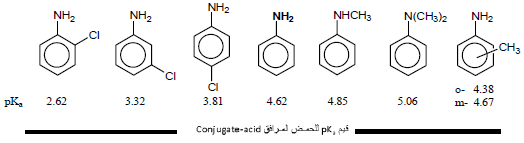
– الجدول التالي يوضح بعض قيم pKa لأيونات Anilinium
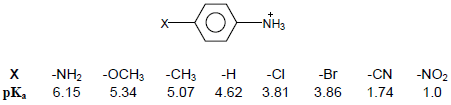
ثالثاً/ قاعدية الأمينات الحلقية غير المتجانسة
– تزداد كهروسالبية ذرة النيتروجين بزيادة صفة فلك (s) في التهجين وكلما زادت كهروسالبية ذرة النيتروجين كلما قلت فاعليتها وذلك بسبب المشاركة بزوج الإلكترونات غير الرابط وبالتالي تقل القاعدية.
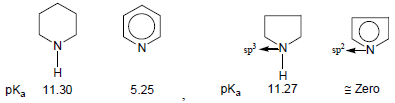
أسئلة محلولة
مثال(1): أي مركب في الأزواج التالية له قاعدية أعلى ؟
(1) CH3CH2NH2 , CH3CH2CONH2
(2) NaOH , CH3NH2
(3) CH3NHCH3 , CH3OCH3
الحل:
(1) CH3CH2NH2
(2) NaOH
(3) CH3NHCH3
مثال(2): كيف تفسر أن للأمينات قاعدية أعلى من الإيثرات رغم أن الكهروسالبية للأكسجين أعلى من النيتروجين؟
الحل:
يفسر ذلك على أساس الكاتيون الناتج حيث تتحمل ذرة النيتروجين الشحنة الموجبة أكثر من ذرة الأكسجين.
مثال(3): إذا كانت قيمة pKa لأيون Benzyl ammonium هي 9.33 فكم تكون قيمة pKa للمركب Benzyl amine؟
الحل:
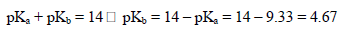
مثال (4): أي من الجزيئين التاليين أعلى قاعدية ولماذا NF3 , NH3؟
الحل:
NH3 هو الجزئ الأعلى قاعدية لأن ذرة النيتروجين تحمل شحنة سالبة جزئياً ، أما ذرة النتيروجين في جزئ NF3 على العكس من ذلك بسبب الكهروسالبية العالية لذرة الفلور.
مثال (5): كيف تفسر قاعدية متشكلات Nitroaniline من خلال قيم Ka التالية؟
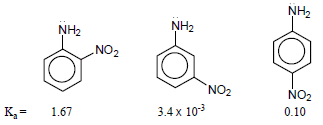
الحل:
قاعدية متشكل ميتا > قاعدية متشكل بارا > قاعدية متشكل أورثو
وذلك لعدم تأثير مجموعة النيترو في موقع ميتا على الأزواج الإلكترونية بسبب عدم وجود شحنة سالبة في الموقع ميتا.
المراجع :
– أسس الكيمياء العضوية / وائل غالب محمد – وليد محمد السعيطي / الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا




قارن من حيث القاعدية بين amide و imide