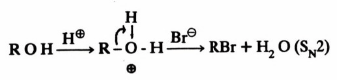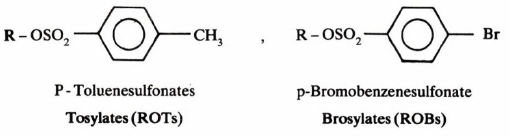تأثير المجموعة المغادرة leaving group على تفاعلات SN1 , SN2
تناولنا في الموضوعات السابقة بعض العوامل المؤثرة على تفاعلات الاستبدال النيكليوفيلية SN1 , SN2 . وفى هذا الموضوع نستكمل تأثير المجموعة المغادرة وتأثير المذيب على تلك التفاعلات.
العوامل المؤثرة على تفاعلات الاستبدال النيكليوفيلية
(1) تأثير بنية المادة المتفاعلة Substrate Structure
(2) تأثير المجموعات المهاجمة Attacking Nucleophile
(3) تأثير المجموعة المغادرة leaving group
أضغط على أي عنصر مما سبق لقراءته.
أولاً/ تأثير المجموعة المغادرة على تفاعلات الاستبدال النيكليوفيلية
(1) تأثير المجموعة المغادرة على الكـربـون المشبع
– إن المجموعة أو الذرة المغادرة تنفصل بسهولة ويسر كلما كانت على درجة عالية من الثبات بعد انفصالها. وهذا يعني أن المجموعة المغادرة يجب أن تكون ذات قاعدية ضعيفة.
– ومثال على ذلك فإن أيون اليود يكون أسهل خروجاً من بقية الهاليدات. وعلى العكس من ذلك فإن أيون الفلور يكون أصعبها خروجاً.
– وهناك عوامل كثيرة تساعد على تسهيل خروج المجمـوعـة المغادرة. ومثال على ذلك نجد أن مجموعة OH– في الكحولات و OR– في الاسترات مجاميع يصعب خروجها ولكن عند وجود حمض كعامل مسـاعـد فإن الكحول يصبح على شكل ROH والأثير على شكل ROHR وهذا يسهل عملية الخروج. ويتضح ذلك من المثال التالي:
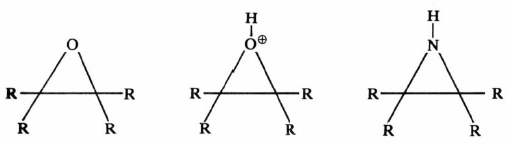
– أما في حالة الإيبوكسايد الحاوي على البروتون فينشطر بسهولة، ويرجع السبب هنا إلى ما نسميه بالتوتر الحلقي (Ring strain) . كذلك الحال في المركبات ثلاثية الحلقة التي تحتوي على الكبريت، والنيتروجين أيضا تنشطر بسهولة لنفس السبب.
– ومن المعلوم لدينا أن تفاعلات SN1 لا تحتاج إلى عامل نيكليوفيلي قوي ، لكنها تحتاج إلى مجموعة مهاجرة نشطة (Good leaving group) ومعظم تفاعلاتها تتم في وسط حمضي على العكس من تفاعلات SN2 ، التي تحتاج إلى عامل نيكليوفيلي قوي ومعظم تفاعلاتها تتم في وسط قاعدي.
– كما أنه من المعروف أن الهاليدات من العوامل النيكليوفيلية المشهورة في تفاعلات الاستبدال. وقد بينا فيها سبق كيف أن اليود يسهل خروجه مقارنة مع الفلور.
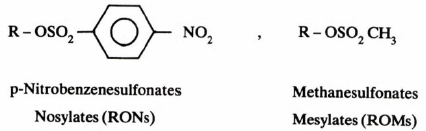
– وكما سبق وأشرنا بأن إضافة الحمض يسهل من عملية خروج مجموعة OH في الكحولات إلا أن هناك طريقة أخرى. وهي تحويل الكحولات إلى إسترات نشطة (Ester) وأكثرها شيوعا هي سلفونات الإستر ( Sulfonic ester). وإن أهم مجاميع سلفونات الإستر المتداولة هي Tosylate, Brosylate, Nosylate & Mesylate وجميعهـا مجموعات تعتبر نشطة وسهلة الخروج مقارنة مع الهاليدات.
مجموعات مغادرة سريعة الخروج
تمكن الباحثون في السنوات الأخيرة من إيجاد مجموعات سريعة الخروج. وإن المركبات التي تحتويها تعتبر من أقوى عوامل الألكلة (Alkylating agents) وأهمها:
- أيونات الأوكسونيوم RO+R2) – Oxonium)
- ألكيل البيروكلوريت Alkylperchlorates (ROClO3)
- مركبات الفلور المختلفة مثل:
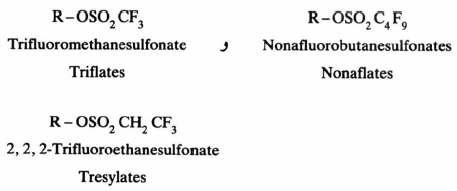
– وبمقارنة سرعة خروج المجموعتين التاليتين Triflates, Tresylates وجد أن Tresylates أضعف بمقدار 400 مرة من Triflates لكنها أنشط بمقدار 100 مرة من Tosylates کما وجد من جهة أخرى أن Tresylates أنشط بمقدار 100 مرة من Tosylates
(2) تأثير المجموعة المغادرة على ذرة كربون مجموعة الكربونيل
– في تفاعلات الاستبدال بنوعيه على مجموعة الكربونيل وجد أن خروج المجموعة (أو الذرة) المغادرة خلال الخطوة البطيئة والمحددة لسرعة التفاعل يؤثر مباشرة على سرعة التفاعل.
وبمعرفتنا لميكانيكية تفاعلات الاستبدال على ذرة الكربون في الكربونيل نجد أن الرابطة بين المجموعة المغادرة والمادة المتفاعلة تظل مرتبطة جزئياً أثناء الخطوة البطيئة.
– كما أن طبيعة المجمـوعـة المغادرة أيضا لها تأثير واضح على نشاط تفاعلات مجموعة الكربونيل وفي اتجاهين:
(1) تأثيرها على الكثافة الإلكترونية على ذرة كربون مجموعة الكربونيل مما يؤثر على سرعة التفاعل.
(2) أن طبيعة المجموعة المغادرة تؤثر على موقع التوازن بين المواد المتفاعلة والناتجة من التفاعل.
ويتضح ذلك من المثال التالي:
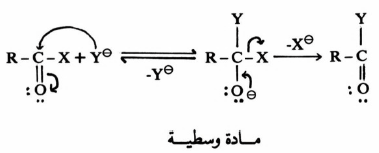
حيث أنه عند الحصول على المادة الوسطية، تكون هناك منافسة بين خروج X أو Y:
عندما تكون X مجموعة خارجة ضعيفة فإن Y هي التي تخرج، وهذا يؤدي إلى الحصول على المادة المتفاعلة.
وعندما تكون X مجموعة خارجة أسهل من Y يؤدي ذلك لتكون الناتج النهائي.
وعلى ضوء ذلك يمكن ترتيب درجة نشاط مركبات الكربونيل كالتالي:
–RCOCl > RCOOCOR‘ > RCOOAr > RCOOR’ > RCONH2 > RCONR’2 > RCOO
ويتضح من هذا الترتيب أن درجة ثبات أنيون المجموعة المغادرة يزيد من نشاط المادة المتفاعلة.
ثانياً/ تأثير المذيـب على تفاعلات الاستبدال النيكلوفيلية
لقد سبق وتعرفنا على تفاعلات الاستبدال النيكليوفيلي فوجدنا أنها عبارة عن تفاعلات قطبية وعليه فهي تفضل المذيبات القطبية كوسط للتفاعل.
– وبصفة عامة يمكن القول بأن تفـاعـلات الاستبدال من الدرجة الأولى SN1 ، تتأثر فيها سرعة التفاعل تأثراً ملحوظاً بقطبية المذيب. فكلما كانت قطبية المذيب عالية كلما زادت سرعة التفاعل. ويرجع السبب إلى تثبيت المركبات الوسطية التي تنشأ في الحالة الانتقالية قبل تكون الناتج الأخير حيث يكون المذيب هالة حول المركب الوسطي.
– وفي هذا الصدد نستطيع أن نميز بين نوعين من المذيبات وهي:
(1) مذيبات قطبية بروتونية بخواص نيكليوفيلية وإلكتروفيلية
– وهي ذات قطبية عالية وتسمى ( Protic) کما أن ذرة الهيدروجين لها خاصية حمضية.
– ومن أمثلتها الماء ، الكحول، الأحماض الكـربـوكسيلية، والنشادر ـ وما شابه ذلك.
– حيث تقوم هذه المذيبات في تفاعلات SN1 على تثبيت أيون الكربونيوم المتكون في الحالة الوسطية عن طریق تكون روابط هيدروجينية .
– وهذا النوع من المذيبات يتميز بأنه نيكليوفيلي حيث أن له القدرة على تقديم زوج إلكتروني حر إلى ذرة الكربون المركزية أو من جهة أخرى يكون المذيب إلكتروفيلياً. إذ يقوم الهيدروجين بالارتباط مع الأيون السالب مما يساعد على تسهيل خروج المجموعة المغادرة وتكون الحالة الوسطية.
– وبهاتين الخاصيتين يستطيع المذيب أن يتجمع حول الأيونات الناتجة في الحالة الوسطية لتفاعلات الاستبدال من الدرجة الأولى ويكون عليهـا هالة أيونية مخالفة للشحنة الأصلية على مثل هذه الأيونات ، وبذلك يساعد على عزل هذه الأيونات، ويسهل عملية مهاجمة أيون الكربونيوم الناتج بواسطة العامل النيكليوفيلي الموجود في وسط التفاعل مما يدل على أن هذا النوع من المذيبات يسهل عملية الاستبدال في تفاعلات SN1
(2) مذيبات قطبية نيكليوفيلية
وهي مذيبات قطبية نيكليوفيلية تحمل الذرة المركزية فيها زوجاً إلكترونياً حراً ولا تحمل جزيئات هذه المذيبات ذرة هيدروجين لها صفة حمضية.
– مثل مذيبات النوع الأول وتـسـمـى غير بروتـونـية (Aprotic) وأمـثـلتـهـا ثنـائي ميثيل الفـورمـامـايد Dimethylformamide ,(CH3)2 NCHO ، الأسيتون، Dimethylsulfoxide (CH3)2SO ، الاسيتونيترايل CH3CN ، والنيتروبنزين C6H5NO2 ، وما شابهها.
– وتصلح هذه المذيبات لتفاعلات الاستبدال من الدرجة الثانية SN2 ، حيث أنه من المعلوم أن تفاعلات الاستبدال النيكليوفيلي من الدرجة الثانية لا تتكون فيه حالة وسطية أيونية لكن الشحنة الناتجة على الحالة الوسطية تتوزع على أكثر من ذرة كربون .
– وبصفة عامة فلقد وجد أن المذيبات من النوع الأول تعمل على إعاقة تفاعلات SN2 حيث إنه في هذه الحالة لا فائدة للهالة التي يكونها المذيب من النوع الأول.
أمثلة على تأثير المذيبات القطبية على سرعة تفاعلات الاستبدال النيكلوفيلية
– وجد أن سرعة التفاعل النسبية عند درجة ٢٥مo لتفاعل يوديد الميثيل ( CH3I) مع أيون الكلور تساوي (1) في الميثانول وتزيد سرعة التفاعل إلى حوالي 45 مرة في مذيب مثل: N-ميثيل فورمامايد HCONHMe ، بينما تزيد سرعة التفاعل حوالي مليون مرة عند استخدام مذيب مثل N , N ثنائي مثيل الفورمامايد.
– ومن هذا يتضح أن سرعة التفاعل من نوع SN2 تزداد زيادة واضحة عندما يتغير المذيب من النوع الأول إلى النوع الثاني.
– العامل النيكليوفيلي تزداد أفضليته بزيادة حجمه. وذلك لأن النيكليوفيل صغير الحجم تتكون حوله هالة عند استخدام مذيبات النوع الأول مما يعيقه عند أداء مهمته. كما أن للرابطة الهيدروجينية دوراً مهما جداً في إعاقة التفاعل.
– أما المذيبات من النوع الثاني فإنها تعمل على استقطاب الأيونات السالبة بصورة أفضل. مما يساعد على ثبات الحالة الوسطية في تفاعلات SN2
من هذا يتبين لنا أنه بالإمكان التحكم في نوع التفاعل باختيار المذيب المناسب والذي يساعد على التفاعل المطلوب.
– ومن الجدير بالذكر أن مزج مذيب من النوع الأول مع مذيب من النوع الثاني ينشط تفاعل الاستبدال من الـدرجـة الأولى.
– كما أن مزيجاً من النوع الأول مثل الماء والميثانول يساعد تفاعلات SN1 حيث يعزز تكون أيون الكربونيوم ويساعد على استقراره. وكلما كانت نسبة الماء أعلى كلما كان التفاعل أسرع، ولكنه أحياناً تتكون تفاعلات جانبية حيث تدخل –HO في التفاعل.
تأثير أضافة ملح مع المذيب في تفاعلات الاستبدال النيكلوفيلية
– يتضح مما سبق أن قطبية المذيب وقوة الأيونات (Ionic strength) في الوسط يؤثر على سرعة تفاعلات SN2 , SN1.
– وعلى العموم، فإن إضافة ملح يؤثر على سرعة SN2 , SN1 بنفس الدرجة، حيث يعمل على زيادة قطبية المذيب.
– ويختلف التأثير باختلاف نوع الملح المضاف، مع بعض الاستثناءات:
– فمثلاً وجد أن سرعة تفاعلات SN1 تزداد بزيادة الملح نتيجة تأثير الأيون المشترك (Common ion effect). كما أن هناك تأثيراً خاصاً لبعض الأملاح مثل LiBr, LiClO4 حيث تعمل على فصل الحالة الانتقالية وتكون مركباً غير ثابت يتحول بسرعة إلى الناتج.
– أما في حالة وجود بعض الأيونات التي تسـاعـد على سحب المجمـوعـة المغادرة في حالة تفـاعـلات SN1 مثـل أبونـات +++Ag+ , Hg++ , Hg2++ , Zn++ , Al فإنها تعمل على زيادة سرعة تفاعل SN1 ويرجع ذلك إلى أن الأيونات السابقة الذكر تقوم بتثبيت الأنيونات المتكونة خلال التفاعل وتفسح المجال للكاتيونات كي تلتقي بالعوامل النيكليوفيلية، ولذلك فإن الأملاح الهالوجينية للعناصر السابقة تضاف لتعزز تفاعلات
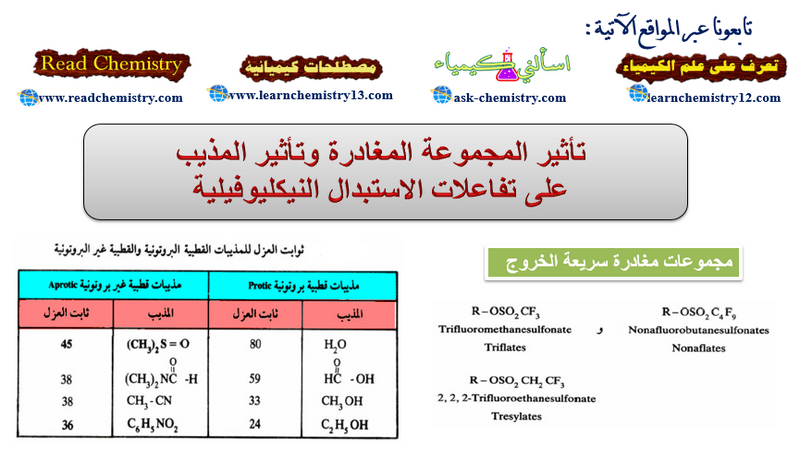
ثابت العزل للمذيبات القطبية
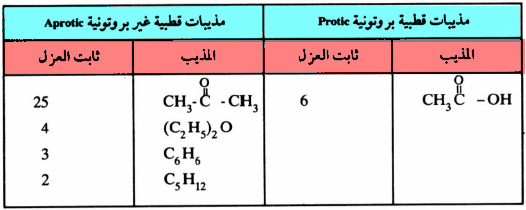
– وتجدر الإشارة هنا إلى أن خير تعبير عن قطبية المذيب هو التعرف على ثابت العزل لهذه المذيبات (Dielectric constant) . فكلما كان ثابت العزل كبيراً، كلما كانت قطبية المذيب عالية وقدرته على الحل (Solvation) كبيرة في الحالة الانتقالية.
– ويوضح الجدول التالي قيم ثابت العزل للمذيبات القطبية البروتونية وكذلك المذيبات القطبية غير البروتونية.
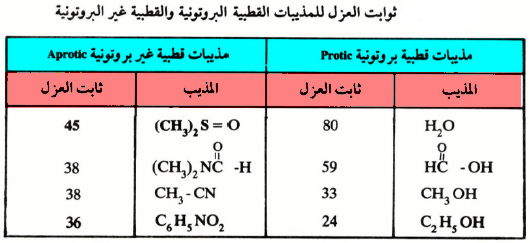
– ويتضح من الجدول أن مذيبات النوع الثاني ذات القطبية العالية تساعد على سرعة تفاعلات SN2. وذلك لأن العامل النيكليوفيلي هنا تتكون عليه هالة (Unsolvated) وعليه يكون أكثر نشاطاً.
– ولا يفوتنا هنا أن نذكر بأن وجود الهالوجين في موضع β يقوم بإبطاء سرعة تفاعلات SN1 ذلك لأن فعله التحريضي يغلب في مثل هذه الحالة على فعله الطنيني (الرنيني).
المراجع: كتاب ميكانيكية التفاعلات العضوية ، تأليف/ د.سالم بن شويهان ، د. إبراهيم بن محمود النجار ، د. حمد بن عبدالله اللحيدان ، الرياض – جامعة الملك سعود – الطبعة الثانية 2003م