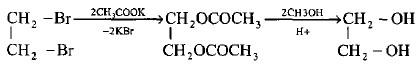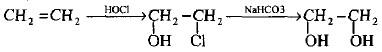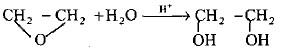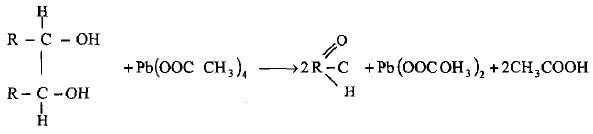الإيثيلين جليكول Ethylene Glycol ( طرق التحضير – التفاعلات – الاستخدامات)
– في هذا الموضوع سيتم مناقشة مركب الإيثيلين جليكول Ethylene Glycol كمثال على مركبات الكحولات ثنائية الهيدروكسيل Glycols.
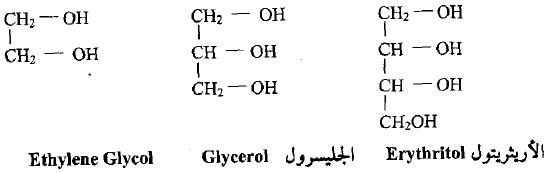
الكحولات متعددة الهيدروكسيل Polyhydric Alcohol
– هي المركبات المشتقة من الهيدروكربونات الاعتيادية والمشبعة من خلال إبدال ذرات الهيدروجين المرتبطة بذرات الكربون المتجاورة بمجاميع هيدروكسيل.
– أبسط أمثلة لهذه المركبات هي الإثيلين جلايكول ( ثنائي الكحول) والجليسرول (ثلاثي الكحول) والأرثيريتول (رباعي الكحول).
– تزداد ذوبانية هذه المركبات في الماء بينما تقل في الأثير بزيادة عدد مجاميع الهيدروكسيل في المركب.
– أن بعضاً من هذه المركبات هي مكونات مهمة في المركبات الطبيعية مثل الجليسرول الذي يوجد في الشحوم والزيوت أما الكحولات المتعددة الكبيرة والحاوية على خمسة أو ستة ذرات كربون مثل الينتيتولات والهكسيتولات فتأتي أهميتها من تشابه تركيبها مع مركبات الكربوهيدرات (السكريات).
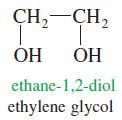
الكحولات الثنائية الجلايكولات أو 2،1 – ثنائي دايول
– هي مركبات ثنائي الكحول المتجاور أو الكحولات الأولية ثنائية الهيدروكسيل مثل الجلايكول 1 ، 2 أو الإثيلين جلايكول HO – CH2 – CH2 – OH
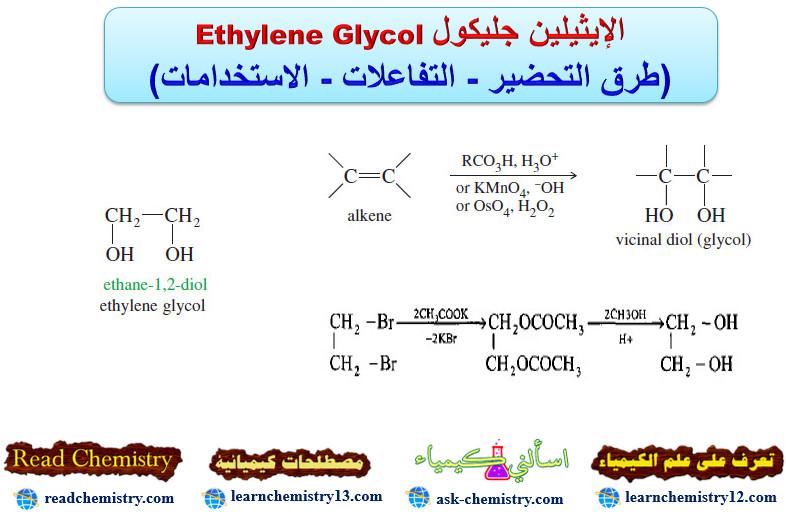
طرق تحضير الكحولات ثنائية الهيدروكسيل Glycols
(1) التحلل المائي القاعدي لهاليدات الألكيل الثنائية المتجاورة
– يمكن الحصول على هذه المركبات وبطريقة مشابهة لتحضير الكحولات الإحادية من خلال التحلل المائي القاعدي لهاليدات الألكيل الثنائية المتجاورة باستخدام هيدروكسيد البوتاسيوم أو كربونات الفلز القلوية.
– لذا فان 1، 2 – ثنائي برومو إيثان يعطي الإثيلين جلايكول ( طريقة فرتز (Wurtz) وقلة الناتج من هذا التفاعل (50%) مرده إلى حذف جزئية HBr وتكوين بروميد الفنيل كناتج عرضي.
– لكن من المفيد هنا تحويل المركب 2،1 – ثنائي برومو الإيثان أولاً إلى جلايكول ثنائي الخلات بواسطة خلات الفضة أو خلات البوتاسيوم ثم التحلل المائي إلى الإستر مع كلوريد الهيدروجين في الميثانول لإعطاء الناتج النهائي (الجلايكول) وبناتج 85%.
(2) صناعياً من الإيثيلين
– يحضر الإيثيلين جليكول صناعياً من الأثيلين بالطرق التالية:
(أ) بأمرار غاز الأثيلين في ماء الكلور (Cl2 / H2O) لإعطاء كلوروهايدر من الأيثيلين والذي يتحلل مائياً بواسطة محلول بيكربونات الصوديوم.
(ب) يتكون الإيثيلين جليكول عند معاملة أكسيد الأثيلين مع حمض الهيدروكلوريك المخفف البارد كما يلي:
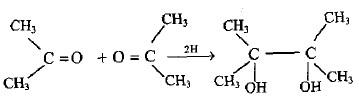
(3) أختزال الكيتونات بواسطة ملغم المغنيسيوم
– بأختزال الكيتونات بواسطة ملغم المغنيسيوم تتكون الجلايكولات الثنائية 1 ، 2 – الثالثية المزدوجة (البيناكول) كما بالتفاعل التالي:
الخواص الفيزيائية للايثيلين جليكول
– الايثيلين جليكول هو الصفات الآتية كما يلي:
- سائل لزج القوام وعديم اللون.
- يغلي في درجة 198مo.
- له طعم حلو المذاق.
- يذوب بلا حدود في الماء والكحول الإثيلي بينما لا يذوب في الأثير.
الخواص الكيميائية للإيثيلين جليكول
– تتشابه الصفات الكيميائية للجلايكولات الثنائية (2،1) مع الحكولات الأحادية عدا أن مجموعتي الهيدروكسيل تتفاعل دائماً بالتتابع لذا يمكن تحضير مشتقاتها الأحادية ومشتقاتها الثنائية مثل أملاح الجلايكولات الأحادية والثنائية وأثيرات الألكيل الإحادية الثنائية والاسترات الأحادية والثنائية.
(1) تفاعل الإيثيلين جليكول مع الأحماض
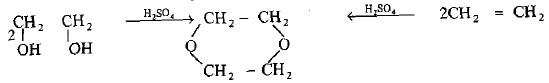
– عند تسخين الإيثيلين جليكول مع كمية قليلة من حمض الكبريتيك المركز أو حمض الفسفوريك المركز فأن الناتج يكون الديوكسان (مذيـب مـهـم) والذي يغلي في درجة 101.5 °م ويذوب في الماء بلا حدود.
– يمكن تحضير الديوكسان من إزدواج جزئيتي أثيلين بفعل حمض الكبريتيك المركز كما بالتفاعل التالي:
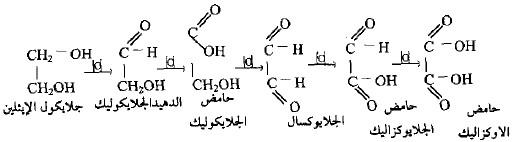
– بسلوك مشابه لأكسدة الكحولات الأولية فإن نواتج الأكسدة للجلايكولات الثنائية تكون على مراحل وتعطي المركبات كما يلي :
– أن أكسدة جلايكول الأثيلين بواسطة حمض النتريك المركز يعطي أولاً كل من حمض الجلايكوليك وحمض الأوكزاليك وبسهولة بينما تكون بقية المركبات الوسطية بكميات قليلة لكونها تتأكسد بسهولة إلى المركبين المستقرين أعلاه، لذا يمكن تحضيرها بواسطة طرق خاصة.
(2) شطر الجلايكولات بالأكسدة
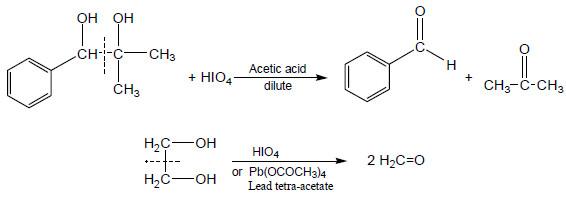
– نظراً لطبيعة الرابطة بين ذرتي الكاربون وارتباط كل منهما مع ذرة أوكسجين ذات السالبية الكهربائية العالية الأمر الذي يؤدي إلى سهولة كسر رابطة C-C وهو ما يدعى بالانشطار الجلايكولي والذي له استخدامات تحضيرية عديدة.
– يتضمن هذا الانشطار أكسدة باستخدام بعض العوامل المؤكسدة المناسبة مثل رابع خلات الرصاص في حمض الخليك الثلجي (طريقة كريكي Criegee) أو حمض البيرايوديك في المحاليل المائية (طريقة مالابريد Malaprade) حيث تكون نواتج الأكسدة أما ألديهدات أو كيتونات.
(3) أختزال الإيثيلين جليكول
أستخدامات الإيثيلين جليكول
– تعتبر مركبات الإيثيلين جليكول وأثيرات الميثيل والأيثيل له والديوكسان مذيبات عضوية مهمة لإصباغ الخشب والملمعات وصناعة خلات السليلوز.
– كما يستخدم الإيثيلين جليكول كمانع للتجمد أحياناً بدلاً من الجليسرول بينما يدخل مركب كلوروهايدرين الجلايكول كمادة أولية في بعض تفاعلات الأصطناع.
المراجع
- الكيمياء العضوية الإليفاتية – د/ عادل شاكر الطائي – دار المسيرة للنشر والتوزيع – عمان – الأردن – 2009
- Organic chemistry / L.G. Wade, Jr / 8th ed, 2013 / Pearson Education, Inc. USA.
- Unergraduate Organic Chemistry /Dr. Jagdamba Singh, Dr. L.D.S Yadav / 1st ed, 2010/ Pragati prakashan Educational Publishers, India.
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) . United States