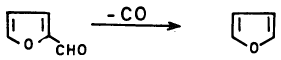مشتقات الفيوران Furan derivatives
ما هو الفيوران Furan؟
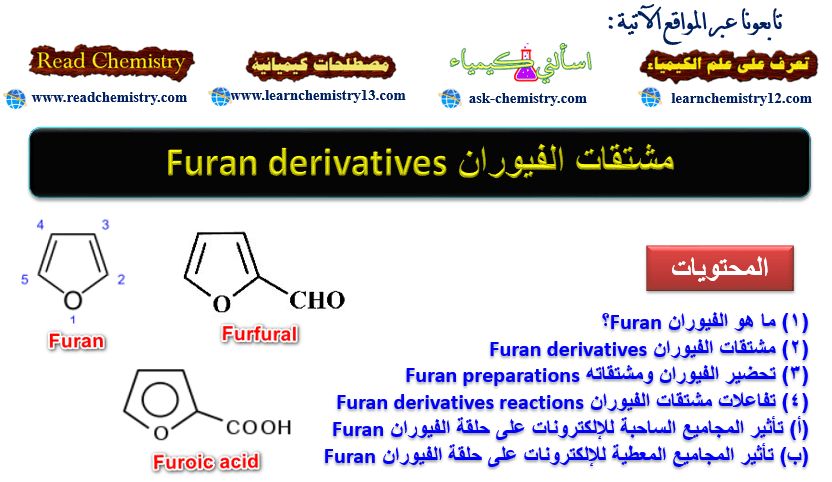
الفيوران Furan مركب خماسي الحلقة غير متجانس يحتوي على ذرة أكسجين واحدة.
– يحدد مكان السلسة الجانبية أو المجاميع الفعالة على الحلقة بأعداد ويجب أن تأخذ ذرة الأكسجين رقم (1)
– يوجد في قطران خشب الصنوبر.
– اكتشف الفيوران ومشتقاته في حوالي القرن الثامن عشر، عن طريق تقطير حمض الميوسيك، وكذلك بواسطة تأثير حمض الكبريتيك وثاني أكسيد المنجنيز على السكر.
– يعتبر الفيور فيورال من أكثر مشتقات الفيوران المعروفة وهو ينتج عن طريق التحلل المائي للبنتوزنات الموجودة في نخالة الشعير وقشـور الشوفان حيث يتحول إلى البنتوزات ليعطي الفيورفيورال عند نزع جزيء الماء منه.
-هو مركب عديم اللون ولكنه يتغير إذا تعرض للهواء الجوي.
– يعتبر مادة مهمة من الناحية الصناعية.
مشتقات الفيوران Furan derivatives
هناك عدد كبير من مشتقات الفيوران منها:
- مشتقات الفيوران المشبعة
- ومشتقات الفيوران الألكيلية والأريلية
- مشتقات الفيوران الهالوجينية
- النيتروفيوران
- هيدروكسيل الفيوران والأمينوفيوران
- مشتقات الفيوران المعدنية
تحضير الفيوران ومشتقاته Furan preparations
– يمكن الحصول على الفيوران Furan من تقطير الخشب وخصوصا خشب الصنوبر.
– کما أنه يمكن تحضيره بالطرق الآتية:
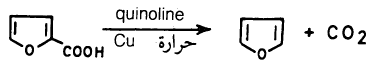
(1) تسخين حمض الفيوريك مع الكينولين في وجود النحاس
حيث تنتزع مجموعة الكربوكسيل ونحصل على الفيوران مع العلم أن حمض الفيوريك يحضر من تقطير حمض الميوسيك.
(2) تسخين الفيورفيورال إلى الحالة البخارية في وجود عامل مساعد
يحضر الفيوران في الصنـاعـة عن طريق تسخين الفيورفيورال إلى الحالة البخارية في وجود عامل مساعد مثل النيكل حيث ينزع أول أكسيد الكربون ويتكون الفيوران.
(3) من 4.1- مجموعة الكربونيل مع عامل نازع للماء
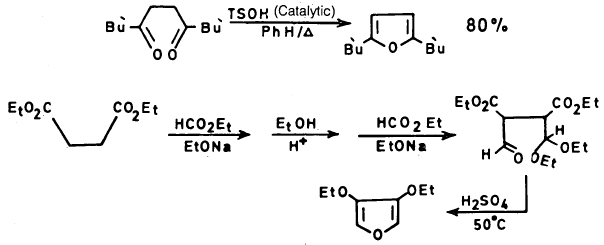
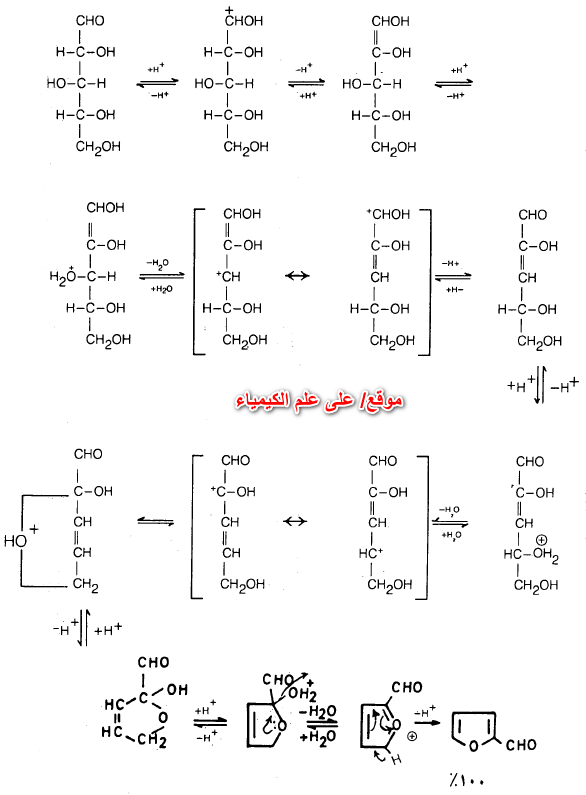
يمكن أن يحضر الفيوران من 4.1- مجموعة الكربونيل المناسبة سواء كانت الدهيدية أو كيتونية أو غيرها.
ويستخدم عامل نازع للماء مثل H2SO4 أو P2O5 على أن يكون وسط التفاعل حمضياً ولا يكون مائياً ويمكن أن يتم هذا التفاعل كما يلي:
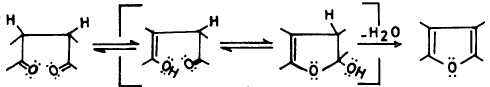
أما ميكانيكية التفاعل الأول فيعتقد أنها تتم كما يلي:
(4) من إثيل أسيتـواسـيتـات ( Ethyl acetoacetate) في وجـود قاعـدة قوية واليود.
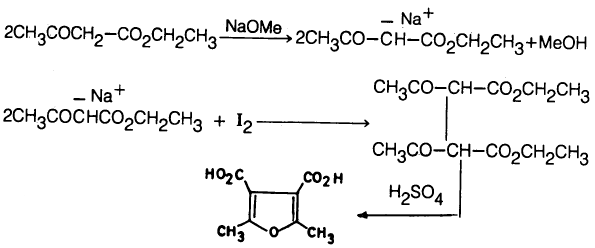
كما أنه يمكن تحضير مشتقـات الفيوران من إثيل أسيتـواسـيتـات (Ethyl acetoacetate) في وجـود قاعـدة قوية واليود حيث يتكون ثنائي اسيتواستر حمض السكسنيك (Di aceto succinic ester) والذي يسخن بدوره مع حمض الكبريتيك حيث يعطي مشتق الفيوران.
(5) طريقة فيست ـ بيناري Felst – Banary synthesis
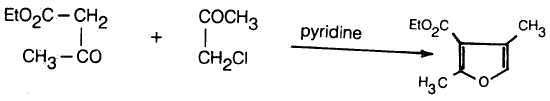
في هذه الطريقة يتم التفاعل بين الفا ـ كلوروكيتون مع بيتا ـ كيتواستر في وجود قاعدة مثل البيريدين .
تفاعلات مشتقات الفيوران Furan derivatives reactions
نلخص تفاعلات مشتقات الفيوران بصفة عامة إذا ما تعرضنا إلى تأثير المجاميع الساحبة للإلكترونات والمجاميع المعطية للإلكترونات على خواص الفيوران في العجالة التالية:
أولاً/ تأثير المجاميع الساحبة للإلكترونات على حلقة الفيوران Furan
– بصفة عامة وجود المجموعات الساحبة للإلكترونات يزيد من ثبات الفيوران.
– وذلك أن مثل هذه المجاميع تعمل على سحب الإلكترونات من الحلقة ويعوض هذا النقص من ذرة الأكسجين وهـذا يجعـل الخاصية العطرية للحلقة تزيد وذلك لأن الإلكترونات تصبح أقدر على الرنين ( More delocalized) مما كانت عليه من قبل.
– وهذا يجعـل الحلقة أكثر مقاومة للحموض فعلى سبيل المثال تتم نيترة الفيوران نفسه تحت شروط هادئة بينما وجود مجموعة ساحبة للإلكترونات مثل مجموعة النيترو والهالوجين وكذلك الكربونيل تجعل عملية النيترة تتم تحت شروط مماثلة لتلك التي للبنزين.
– ومن أهم مشتقات الفيوران التي تحمل مجموعة ساحبة للإلكترونات هي:
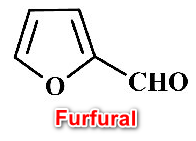
(1) الفيورفيورال Furfural
– هو عبارة عن مركب الفيوران مرتبط بمجموعة الألدهيد فى الموضع (2)
– يتم تحضيره بتحلل عديدة التسكر مثل البنتوزات في الوسط الحمضي المخفف ومن ثم نزع الماء بواسطة حمض H2SO4
– وهذا المركب يغلي عند درجة 162 مo
– ويشبه من حيث الخواص الكيميائية البنزالدهيد فعلى سبيل المثال يقوم بالتفاعلات الآتية:-
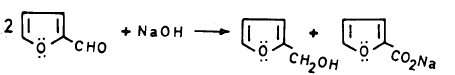
(أ) تفـاعـل الفيورفيورال مع هيدروكسيد الصوديوم
يتفـاعـل الفيورفيورال مع هيدروكسيد الصوديوم حيث ينتج كحـول الفيوروفيورال وحمض الفيورويك (تفاعل كانيزارو).
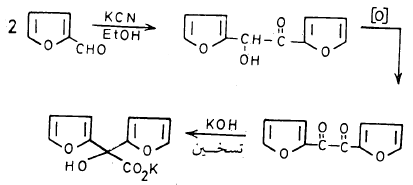
(ب) تفـاعـل الفيورفيورال مع سيانيد البوتاسيوم في الإيثانول
يتفـاعـل مع سيانيد البوتاسيوم في الإيثانول ويعطي الفيورئين (Furoin تكاثف البنزوئين، وهذا يمكن أكسدته إلى الفيوريل (Furil) وهذا بدوره يقوم بعملية تحول موضعي إذا سخن مع هيدروكسيد البوتاسيوم حيث يعطي حمض الفيوريليك (Furilic acid) وهذا يشبه التحول الموضعي لحمض البنزيليك.
والمعادلة التالية توضح هذه السلسلة من التفاعلات:
(جـ) تفاعلات بيركن وكليزن للفيورفيورال
يستطيع الفيوروفيورال أن يقوم بتفاعلات بيركن وكليزن ويتأكسد بسهولة بواسطة أكسيد الفضة إلى حمض الفيوريك.
– ويمكن الكشف عن الفيوروفيورال بتفاعله مع الإيثلين في وجـود حمض الهيدروجين حيث يعطي لوناً أحمر.
استعمالات الفيوروفيورال
يستخدم الفيورفيورال في صناعة الأصباغ والبلاستيك وكذلك كمذيب في صناعة المطاط وفي معامل تكرير البترول.
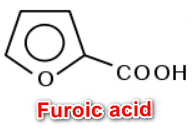
(2) حمض الفيـورويك Furoic acid
– هو عبارة عن مركب الفيوران مرتبط بمجموعة الكربوكسيل فى الموضع (2)
– يحضر هذا المركب عن طريق تقطير حمض الميوسيك أو بأكسدة الفيوروفيورال.
– ويشبه في تفاعلاته تفاعلات الحموض الأليفاتية غير المشبعة.
– ومن أهم تفاعلات حمض الفيورويك:
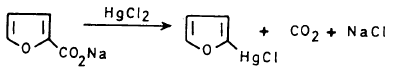
(1) تفاعل ملح حمض الفيورويك مع كلوريد الزئبقيك
يتفاعل ملح الحمض الصوديومي مع كلوريد الزئبقيك ويفقد ثاني أكسيد الكربون HgCl2
حيث يمكن استبدال مجموعة HgCl فيه بالبروم أو اليود أو أية مجموعة أسيلية.
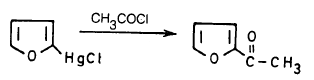
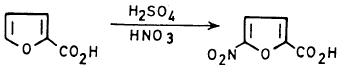
(2) نيترة حمض الفيوريك
ويمكن نيترة حمض الفيوريك مباشرة بواسطة الحموض المركزة حيث تدخل مجموعة النترو موضع (5).
ثانياً/ تأثير المجاميع المعطية للإلكترونات على حلقة الفيوران Furan
إن وجود مجاميع معطية للإلكترونات على حلقة الفيوران يزيد من حساسيتها نحو الحموض ويقلل من استقرارها وبالتالي يزيد من نشاطها والسبب في ذلك أن:
إعطاء إلكترونات من تلك المجموعة المعطية إلى حلقة الفيوران يزيد من قاعدية ذرة الأكسجين وكذلك فعالية الحلقة تجاه العوامل الإلكتروفيلية مما يؤدي إلى حساسيتها تجاه الحموض.
بالإضافة إلى أن الإلكترونات الحرة على ذرة الأكسجين تصبح أكثر استقراراً ( More localized) مما يسبب نقص الصفة الأروماتية وبذلك تصبح حلقة الفيوران حساسة تجاه الحموض مما يجعلها تنكسر أو تتبلمر بكل سهولة.
(1) مشتقات الفيوران الألكيلية
2 ، 5 ثنائي ميثيل فيوران ينفتح بكل سهولة إذا عومل بحمض الكبريتيك في وسط مائي وبالطبع فإن هذا يجعل تحضير الكيلات الفيوران يتم بطرق غير مباشرة:
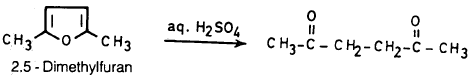
(2) مشتقات الفيوران الأمينية
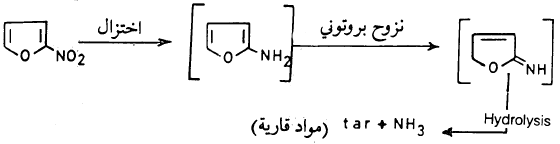
وقد أمكن تحضير بعض مشتقات الفيوران الأمينية بطرق غير مباشرة إلا أن مثل هذه المشتقات على درجة كبيرة من عدم الاستقرار فعلى سبيل المثال محاولة اختزال ۲– نترو فيوران إلى ٢- أمينوفيوران قد فشلت تمامـاً لأن هذا يؤدي إلى تحرر الأمـونيا وتكـون منتجـات قارية، ويحتمـل أن ما يحدث هو حدوث عملية نزوح بروتـوني ( Tautomerization) حيث يتكون الايمين ( Imine) وهذه تكون متبوعة بتحلل مائي ( Hydrolysis) وتبلمر تحت ظروف التفاعل :
وهذا يدل على عدم استقرار مشتقات الفيوران التي تحمل مجموعات معطية للإلكترونات.
(3) مشتقات الفيوران الأمينية
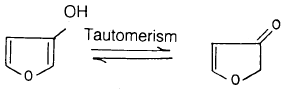
لم يتم تحضير مشتقات الفيوران الهيدروكسيلية الحرة مثل 2- أو 3- هيدروكسي فيوران حتى الآن والسبب في ذلك ربما يعود إلى أن التفاعل الذي يؤدي إلى مثل هذه المركبات المختلفة يعطي مركبات الكربونيل التي تنتج من حدوث عملية النزوح البروتوني (Tautomerism) للمشتق الهيدروكسيلي .
(4) مشتقات الفيوران الهيدروكسيلية
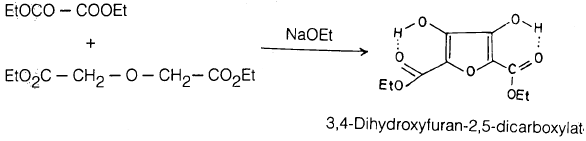
المركب الذي أمكن عزله كمشتق هيدروكسيلي للفيوران هو 3, 4- ثنائي هيدروكسي فيوران – 2 , 5 – ثنائي كربوكسيلات حيث يوجد فقط في الشكل الإينولي.
ومن العوامل التي تساعد على استقراره وجود الروابط الهيدروجينية وقد أمكن تحضيره بالطريقة التالية:
المراجع:
- كتاب المركبات الحلقية غير المتجانسة والحيوية للدكتور حمد بن عبدالله اللحيدان والدكتور محمد بن إبراهيم الحسن والدكتور سالم سليم الذياب – الطبعة الثانية – جامعة الملك سعود – المملكة العربية السعودية
- محاضرات 341 كيم كيمياء المركبات الحلقية غير المتجانسة Chemistry of Heterocyclic Compounds للدكتور عبدالله بن محمد الماجد – جامعة الملك سعود – السعودية
- كتاب الكيمياء العضوية للمؤلف د. حسن محمد الحازمي / الجزء الثاني