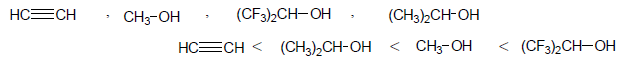الخواص الفيزيائية للكحولات
– في هذا الموضوع سيتم مناقشة الخواص الفيزيائية للكحولات بالتفصيل.
محتويات الموضوع
الخواص الفيزيائية للكحولات Physical properties of alcohols
– وسوف نتناول في هذا الموضوع الخواص الفيزيائية للكحولات كما يلي:
(1) الحالة الفيزيائية للكحولات physical state of alcohols
(2) قطبية الكحولات Polarity of alcohols
(3) درجة غليان الكحولات Boiling Point of alcohols
(4) بالإضافة إلى ذلك ذوبانية الكحولات Solubility of alcohols
(5) حمضية وقاعدية الكحولات acidity and basicity of alcohols
الحالة الفيزيائية للكحولات
– يمكن أن تكون الحالة الفيزيائية للكحولات سوائل أو مواد صلبة كما يلي:
- المركبات الأولي: سوائل خفيفة – تمتزج بالماء امتزاجاً كاملاً.
- المركبات المتوسطة: زيتية القوائم – شحيحة الذوبان فى الماء.
- بينما المركبات العليا: مواد صلبة ذات قوام شمعي – عديمة الذوبان فى الماء.
القطبية Polarity
– أن من أهم الخواص الفيزيائية للكحولات هي القطبية.
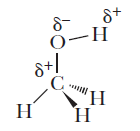
– نظراً لوجود مجموعة OH القطبية فأن الكحولات مركبات قطبية حيث تتكون شحنة موجبة جزيئية على ذرتي الهيدروجين والكربون، كما تتكون شحنة سالبة جزيئية على ذرة الأكسجين وذلك لأن الأكسجين له سالبية كهربية أعلى من الهيدروجين والكربون.
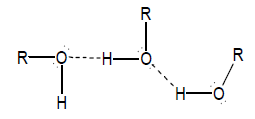
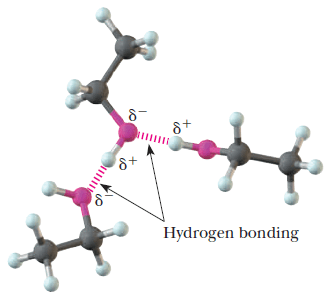
– وهذه القطبية هي السبب في تكوين الروابط الهيدروجينة بين جزئيات الكحولات كما يلي:
درجة الغليان Boiling Point
(1) درجة غليان الكحولات أعلى من درجة غليان الهيدروكربونات
– للكحولات درجة غليان مرتفعة مقارنة بدرجة غليان الهيدروكربونات المقابلة لها في الوزن الجزيئي (الألكانات والأيثرات وهاليدات الألكيل) وذلك لمقدرة الكحولات على تكوين روابط هيدروجينية بين جزيئاتها.
– فمثلاً درجة غليان الميثانول هي 65 Co بينما الأيثان غاز.
– هذه الرابطة الهيدروجينية عبارة عن تجاذب اليكتروستاتيكي يؤدي إلى تجمع الجزيئات لتكون جزيئات أكبر تحفظها سوياً، وترتفع نتيجة لذلك درجات الغليان ، وتزيد الحاجة إلى طاقة أكبر لكسر هذا التجمع الذي لا يوجد مثله في الهيدروكربونات أو الايثرات .
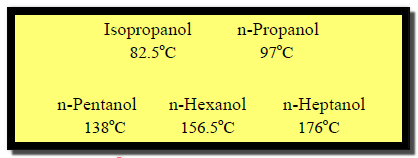
(2) زيادة درجة غليان الكحولات بزيادة الوزن الجزيئي
– تزداد درجة الغليان بزيادة الوزن الجزيئي كما فى الأمثلة التالية.
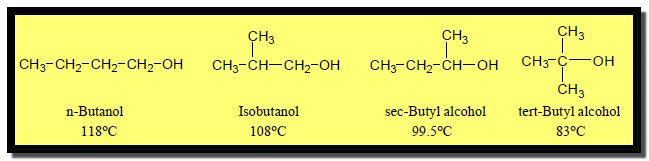
– بينما في المتشكلات الكحولية تقل درجة الغليان بزيادة التفرع في السلسلة الهيدروكربونية حيث تعمل على إبعاد الجزيئات عن بعضها البعض فتقل قوى فاندرفال وتضعف الروابط الهيدروجينية.
(3) درجة الغليان تقل بصغر حجم الجزئ
– كلما صغر حجم جزئ الكحول أو كان يميل للشكل الكروي أكثر كلما قلت درجة الغليان كما فى الأمثلة التالية:
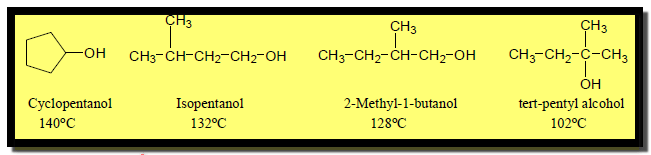
(4) درجة غليان الكحولات الحلقية أعلى من درجة غليان الكحولات غير الحلقية
– نجد أن درجة غليان الكحولات الحلقية أعلى من درجة غليان الكحولات غير الحلقية كما قى الأمثلة الآتية:
الذوبانية Solubility
(1) قدرة الكحولات على تكوين روابط هيدروجينية
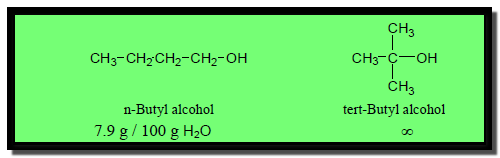
– بسبب مقدرة الكحولات على تكوين روابط هيدروجينية مع جزئيات الماء فأن الكحولات ذات الوزن الجزيئي المنخفض تذوب بأى كمية فى الماء (∞) مثل الميثانول والإيثانول والبروبانول وكحول الأليل.
– بالإضافة إلي ذلك تقل الذوبانية بزيادة طول السلسلة الهيدركربونية لأنها تصبح أكثر شبهاً بالهيدركربونات.
– وكلما صغر حجم مجموعة الألكيل كلما زادت الذوبانية كما فى الأمثلة الآتية:
(2) حجم المجموعة الهيدروكربونية الكارهة للماء
– كلما صغر حجم المجموعة الهيدروكربونية (الكارهة للماء Hydrophobic) في جزئ الكحول كلما زاد ذوبانه في الماء.
– وذوبانية الكحولات الحلقية أعلى من ذوبانية الكحولات غير الحلقية في الماء وذلك لأن حجم الحلقة يكون أصغر كما قى الأمثلة الآتية:
(3) عدد مجموعات الهيدروكسيل
– تزداد كل من درجة الغليان والذوبانية بزيادة عدد مجموعات الهيدروكسيل وذلك بسبب زيادة عدد الروابط الهيدروجينية التي يمكن للجزئ أن يكونها.
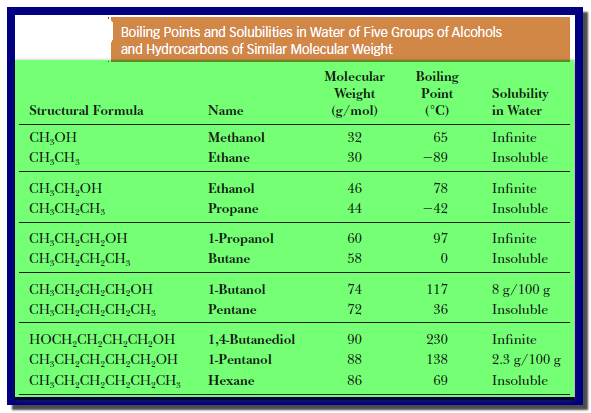
– الجدول التالي كما يلي يوضح درجات الغليان والذوبانية للكحولات مقارنة بالهيدروكربونات المقابلة لها فى الوزن الجزيئي.
حامضية وقاعدية الكحولات acidity and basicity
(1) سلوك الكحولات مشابهاً لسلوك الماء
– تسلك الكحولات سلوكاً مشابهاً لسلوك الماء من حيث الحمضية والقاعدية فهي تسلك سلوك كل من الحوامض الضعيفة والقواعد الضعيفة.
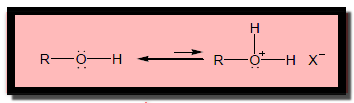
الكحولات كقواعد
– تكتسب الكحولات البروتون بواسطة الأحماض القوية وتتكون ايونات Oxonium – ROH2+
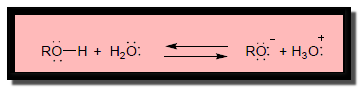
 الكحولات كحوامض
الكحولات كحوامض
– بينما تتفكك الكحولات فى المحاليل المائية وتعطي أيون الهيدرونيوم وأيون Alkoxide – RO–
(2) قيم ثابت التفكك للكحولات
عند مقارنة قيم ثابت التفكك لكل من الماء وأبسط الكحولات مثل الإيثانول والميثانول يتضح التشابة الكبير بين الماء والكحولات كما بالشكل التالي:

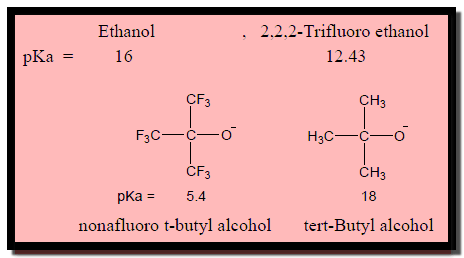
(3) تأثير مجموعات الألكيل
– إن تأثير مجموعات الألكيل على حامضية الكحولات يعتمد على قدرة المذيب في تثبيت أيون alkoxide
– فمثلاً الأيون الأكثر ذوبانية فى الماء هو الأكثر ثباتاً فيه وبالتالي يكون الأعلى حمضية.
– مثال: المركبات Methanol , Ethanol , tert-Butyl alcohol نجد أن الميثانول هي الأعلى كونه الأعلى ذوبانية في الماء كما بالشكل التالي:
(4) تأثير المجموعات الساحبة للألكترونات
– المجموعات الساحبة للألكترونات تأثير هام على حمضية الكحولات حيث يعمل على تثبيت أيون Alkoxide وتكون pKa منخفضة.
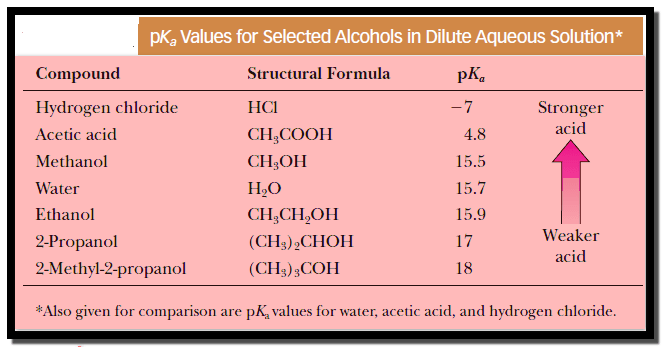
– الجدول التالي كما يلي يوضح قيم pKa لبعض الكحولات في المحاليل المائية المخففة مقارنة ببعض المركبات الأخرى مثل الماء وحمض الهيدروكلوريك وحمض الخليك.
تمارين محلولة على الخواص الفيزيائية للكحولات
تمرين (1): كيف تفسر أن درجة غليان ethylene glycol أعلى من درجتي غليان متشكلات البروبانول رغم التقارب في الوزن الجزيئي؟
الحل:
بسبب احتواء الجزئ على مجموعتى هيدروكسيل فتزداد مقدرته على تكوين روابط هيدروجينية بين جزيئاته أكثر.
تمرين (2): كيف تفسر أن ذوبانية tert-Pentyl alcohol فى الماء أعلى من ذوبانية n- Pentyl alcohol؟
الحل:
بسبب صغر المجموعة الكارهة للماء.
تمرين (3): رتب المركبات التالية على أساس الزيادة في الحمضية؟
الحل:
المراجع :
- أسس الكيمياء العضوية . وائل غالب محمد – وليد محمد السعيطي ، الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا
- أساسيات الكيمياء العضوية. محمد مجدي واصل ، جامعة الأزهر – جمهورية مصر العربية
- Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition ) United States