تفاعلات الألكينات Reactions of Alkenes
في هذا الموضوع سيتم مناقشة جميع تفاعلات الألكينات بالتفصيل والمعادلات الكيميائية حيث جمعنا لك أشهر تفاعلات الألكينات في مقالة واحدة.

(1) تفاعل الاحتراق Combustion
تحترق الألكينات وتعطي H2O ، CO2 وطاقة. ولا يستعمل هذا التفاعل كمصدر للطاقة نظراً لاستخدام الألكينات في التفاعلات الأخرى.
(2) تفاعلات الإضافة Addition reactions
– يؤدى تفاعل الإضافة إلى كسر الرابطة π وتكوين رابطتين σ
– وهذا التفاعل مفضل من حيث الطاقة لأن الحرارة المنبعثة من تكوين رابطتين σ تفوق الطاقة اللازمة لكسر رابطة π وبناءاً علية تكون هذه التفاعلات طاردة للحرارة Exothermic.
– تميل إلكترونات الرابطة تجاه الكواشف الإلكتروفيلية (حمض لويس Lewis acid) وهذا يتطلب نيوكليوفيل قادر على منح زوج من الإلكترونات (قاعدة لويس Lewis base).
– تعتمد تفاعلات الإضافة على نوع المتفاعلات كما يلي :-
- إضافة متفاعلات متماثلة Addition of symmetrical reactants
- إضافة متفاعلات غير متماثلة Addition of unsymmetrical reactants
أولاً/ إضافة المتفاعلات المتماثلة
هي إضافة شقين متماثلين على الرابطة الزوجية .
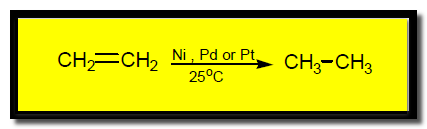
(أ) إضافة الهيدروجين ( الهدرجة Hydrogenation )
حيث يضاف الهيدروجين إلى الرابطة الثنائية فى وجود عوامل حفازة وينتج الألكان المقابل كما يلي:
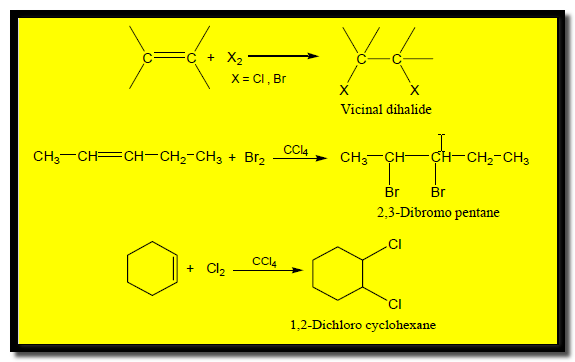
(ب) إضافة الهالوجينات Addition of halogen
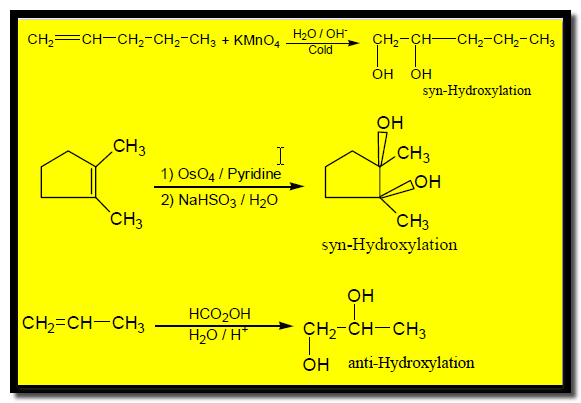
 (جـ) الأكسدة Oxidation
(جـ) الأكسدة Oxidation
تتم الأكسدة بأحد العوامل المؤكسدة التالية وتنتج مركبات ثنائية الهيدروكسيل تسمى دايول:
Potassium permanganate KMnO4
Osmium tetroxide OsO4
Peroxy formic acid HCO2OH
ثانياً/ إضافة المتفاعلات غير المتماثلة
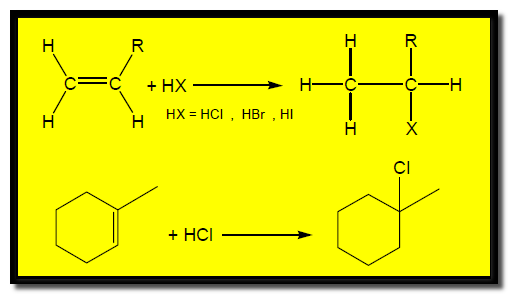
تعتمد إضافة متفاعل غير متماثل للألكين على تماثل أو عدم تماثل الألكين فإذا كان الألكين غير متماثل فأن إضافة الشقين غير المتماثلين تخضع لقاعدة ماركونيكوف.
قاعدة ماركونيكوف Markovnikov,s rule
توصل العالم الروسي Vladimir V. Markovnikov سنة 1869م إلى آلية إضافة المتفاعل غير المتماثل للألكين غير المتماثل حيث تنص على:
(عند الإضافة الأيونية لمتفاعل غير متماثل إلى ألكين غير متماثل فأن الشق الموجب يضاف إلى ذرة الكربون المتصلة بأعلى عدد من ذرات الهيدروجين بينما يتجه الشق السالب لذرة الكربون المتصلة بأقل عدد من ذرات الهيدروجين).
الإضافة حسب قاعدة ماركونيكوف Markovnikov addition
(أ) إضافة هاليدات الهيدروجين Addition of hydrogen halides
لإجراء هذا التفاعل يستخدم الهاليد الغازي بإمراره مباشرة فى الألكين الذي يقوم بعمل المذيب أو عن طريق إذابة هاليد الهيدروجين في حمض الخليك ثم يخلط مع الألكين .
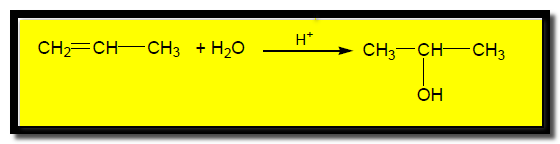
(ب) إضافة الماء ( الإماهة ) Hydration – Addition of water
الإضافة عكس قاعدة ماركونيكوف Anti-Markovnikov addition
(أ) إضافة هاليدات الهيدروجين Addition of hydrogen halides
عند إضافة هاليد الهيدروجين في وجود البيروكسيد فأن الإضافة تتم عكس قاعدة ماركونيكوف كما يلي:
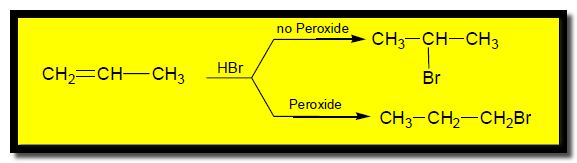
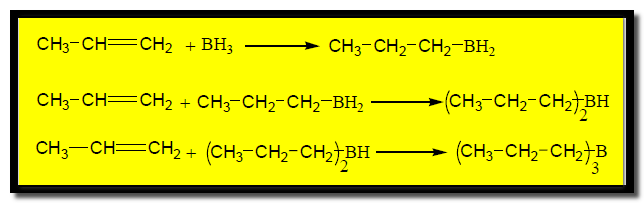
(ب) إماهة الألكين Hydration of alkene
يتم تميه الألكين باستخدام ثنائي هيدريد البورن حيث تُضاف الرابطة B-H من البورن إلى الألكين فيتكون ناتج يسمى Organoborane. كما يلي:
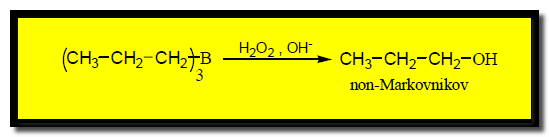
وعند تفاعل ثلاثي الألكيل بورن مع محلول مائي من فوق أكسيد الهيدروجين في وسط قاعدي ينتج كحول بإضافة عكس قاعدة ماركونيكوف .
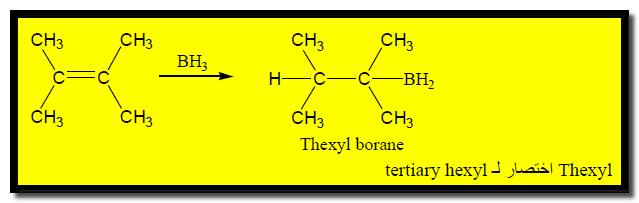
يعتمد ناتج هذا التفاعل على حجم الألكين حيث تسبب الإعاقة المجسامية توقف التفاعل عند الخطوة الأولى أو الثانية.
فعلى سبيل المثال المركب : 2,3Dimethyl-2-butene يتفاعل مع البورن ويعطي ناتج واحد فقط monoalkyl borane بسبب الإعاقة الفراغية.
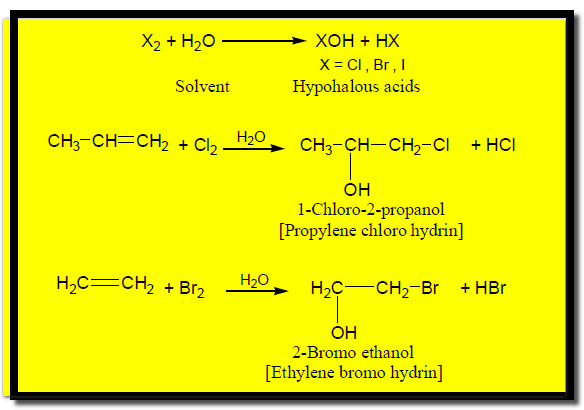
(3) تفاعل تكوين هالوهيدرين Halohydrin formation
(4) تفاعل الألكلة Alkylation
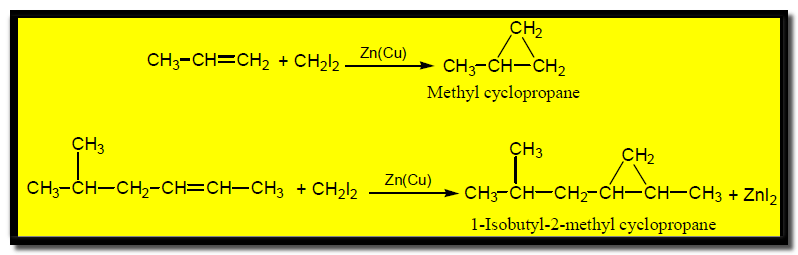
(5) تفاعل إضافة أيودات الكاربين Addition of Carbenoids
حيث يتم معالجة الألكين بــ diiodo methane CH2I2 فى وجود (Zn(Cu ويطلق على هذا التفاعل تفاعل سيمون – سيمث Simmons-Smith reaction كما يلي:
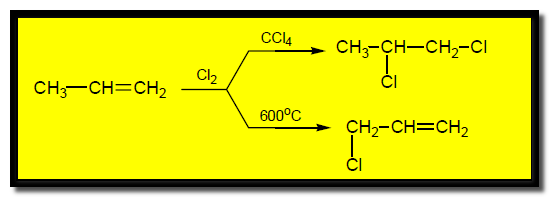
(6) تفاعل الهلجنة والاستبدال الأليلي Halogenation , Allylic substitution
عند الهلجنة في الطور الغازي ودرجة حرارة مرتفعة أو تسليط ضوء مناسب فأن الهلجنة تتم في مجموعة الميثيل ولا تتم إضافة الهالوجين على الرابطة الزوجية كما يلي:
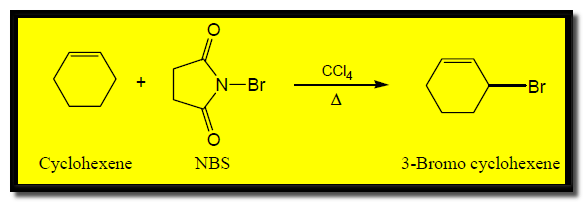
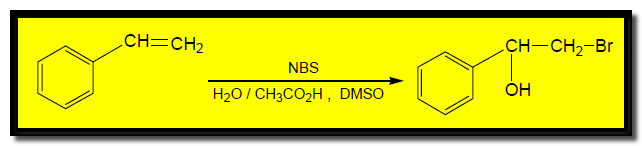
يمكن استخدام (N-Bromo succinimide (NBS لهلجنة الألكينات بالبروم فى الموقع الأليلي دون أن يؤثر على الرابطة المزدوجة.
وعند استخدام كاشف NBS فى وجود الماء والمذيب المناسب مثل dimethyl sulfoxide – DMSO ينتج بروموهيدرين كما يلي:
(7) تفاعلات شطر الألكينات Cleavage of alkenes
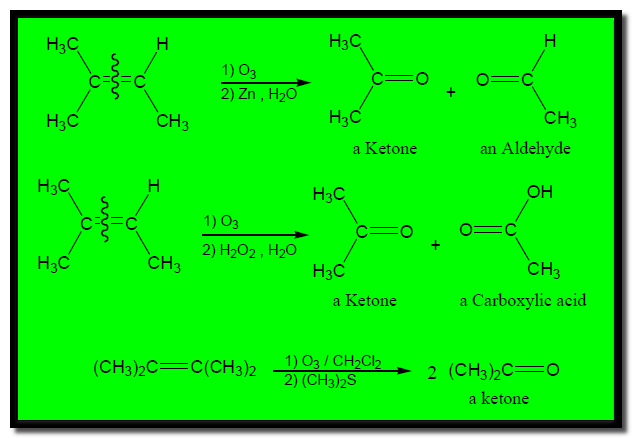
(أ) التفاعل مع الأوزون Ozonization
– يتفاعل الأوزون بقوة مع الألكين ويعطي مركبات تسمى أوزونايد Ozonide التي يتم اختزالها بالخارصين Zn أو dimethyl sulfide (CH3)2S إلى ألدهيدات أو كيتونات.
– وعند إعادة أكسدة مركبات الأوزونايد باستخدام H2O2 يتم تحويلها إلى أحماض كربوكسيلية وكيتونات.
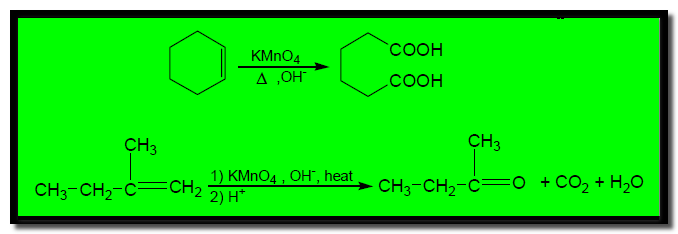
(ب) التفاعل مع برمنجنات البوتاسيوم Potassium permanganate KMnO4
تتفاعل البرمنجنات مع الألكين على الساخن في محلول مركز من أ يون البرمنجنات فينتج كيتونات وأحماض كربوكسيلية و في حالة وجود مجموعة طرفيه –CH2– فأنها تتأكسد إلى CO2 كما يلي:
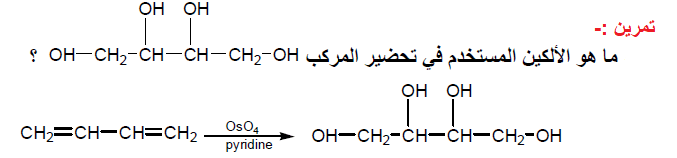
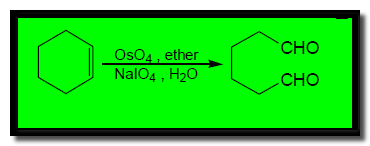
(جـ) التفاعل مع رابع أوكسيد الأوزميوم Osmium tetroxide OsO4
يتم التفاعل فى وجود –Periodate ion IO4 فتنشطر الرابطة الزوجية وتعطي نفس الأنواع من نواتج الانشطار بالأوزون التي تنتج بالاختزال (الدهيدات أو كيتونات ) وتسمى نواتج هذا التحول (أو الانشطار) بــ Lemeiux-.Johnson cleavage
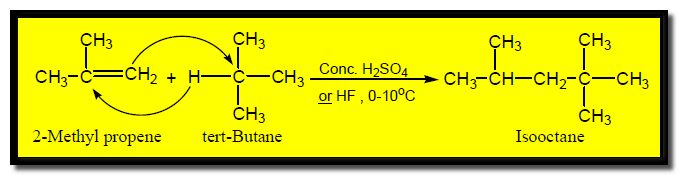
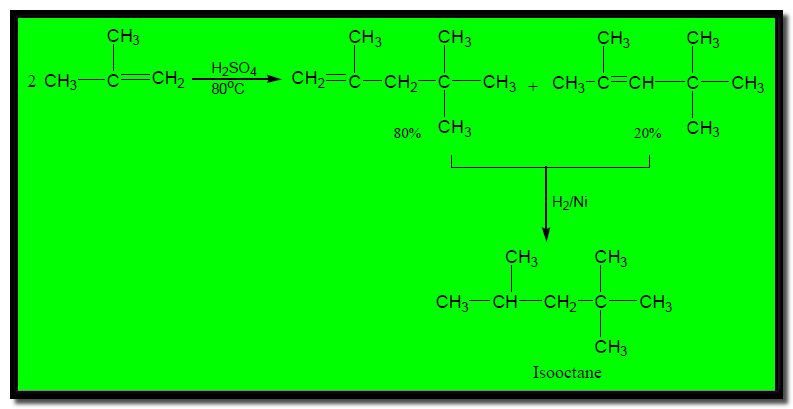
(8) تفاعلات تضاعف الألكينات Dimerization of alkenes
عند تفاعل isobutylene (صيغته الجزيئية C4H8) مع حمض معدني مثل حمض الكبريتيك أو الفسفوريك. يتكون مزيج من جزيئين لألكين مضاعف Dimer (صيغته الجزيئية C8H16) وهذا التفاعل مهم في الصناعة النفطية حيث تعطي هدرجة هذا المزيج مركباً واحد وهو isooctane
أمثلة محلولة
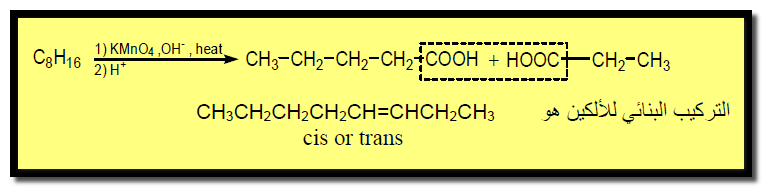
(1) ما هو التركيب البنائي لألكين صيغته الجزيئية عند أكسدته ببرمنجنات البوتاسيوم ينتج حمضين كربوكسيلين هما: CH3CH2CH2CH2COOH , CH3CH2COOH ؟
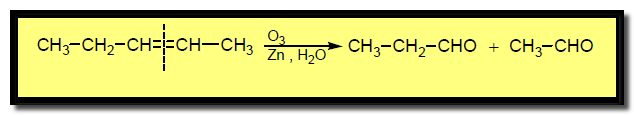
(2) ما هو التركيب البنائي للألكين الذي يعطي المركبات الآتية عند معالجته بالأوزون ثم الخارصين والماء CH3CH2CHO + CH3CHO ؟
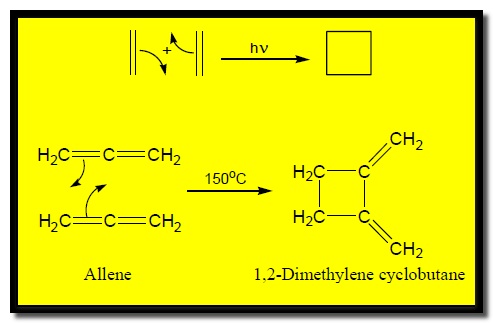
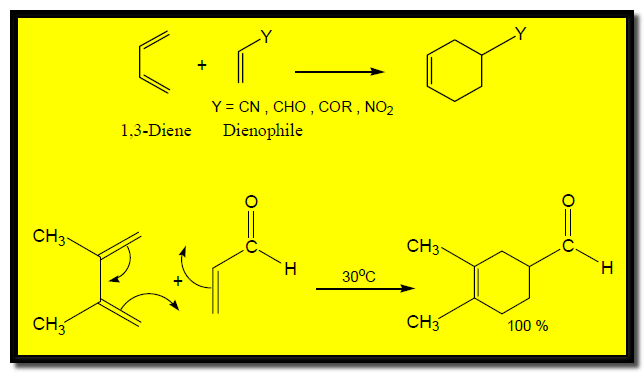
(9) تفاعل الإضافة الحلقية Cycloadition reaction
– يعرف هذا التفاعل بتفاعل ديلز-ألدر نسبة للعالمين الألمانيين Otto Diels ، Kurt Alder.
– وهو عبارة عن تفاعل تضاف فيه الألكينات إلى بعضها أو إلى الدايينات لتكوين مركبات حلقية.
– وتكون المتفاعلات الأساسية في هذا التفاعل هي ألكين مع 1,3diene حيث يسمى الألكين الذي يتحد مع الدايين في هذا التفاعل باسم (dienophile) أي المحب للدايين (diene lover).
عند وجود مجموعة ساحبة للإلكترونات electron-withdrawing group على الرابطة الزوجية dienophile يزداد مردود هذا التفاعل بشكل أكبر. وتكون معادلة التفاعل كما يلي:
(10) البلمرة Polymerization
– هي عملية ربط عدد كبير من الجزئيات الصغيرة والبسيطة لتكوين جزئيات ضخمة ذات وزن جزيئي عالي تدعى البوليمرات polymers التى تتكون من وحدات متكررة تعرف الوحدة منه monomer والتي تتحول إلى البوليمر بتفاعل البلمرة.
– يعتبر إنتاج البوليمرات في الدرجة الثانية بعد إنتاج الفولاذ steel كدليل على حيوية النظم الاقتصادية للدول. حيث تستعمل هذه المواد في معظم الأشياء من حولنا مثل الملابس والطلاء وهياكل السيارات والأكياس واللدائن وغيرها.
– ونظراً للاستعمالات الواسعة لهذه المواد يجب أن تكون قوية ومستقرة وخاملة كيميائياً ولقد استطاع الكيميائيون أن يربطوا بين التركيب الكيميائي للجزئ المبلمر وبين خواصه الطبيعية حيث أمكن تغيير بعض الخواص بما يتوافق مع استعمالاته.
– إن معظم هذه المواد لا تخضع للتحلل الحيوي لأنها تنتج من عمليات مخبريه أو صناعية وليست عمليات تجري في الطبيعة ، ولكن ليست جميع البوليمرات صناعية حيث يوجد مبلمرات طبيعية مثل الحرير والصوف والبروتينات والنشا.
– تنقسم تفاعلات البلمرة إلى نوعان هما: بلمرة الإضافة وبلمرة التكثيف .
أولاً / بوليمرات الإضافة Addition Polymers
– هي عبارة عن تفاعلات يتم فيها إضافة عدد كبير من جزيئات الألكين بحيث يكون الناتج الوحيد من التفاعل هو البوليمر.
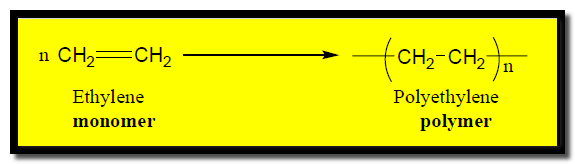
– مثال : تحت ضغط وحرارة مرتفعين وفي وجود الأكسجين يتعرض الإيثيلين للبلمرة بالإضافة. حيث تُضاف جزيئات الإيثيلين لبعضها وتنتج ألكانات طويلة السلسلة من نوع البلاستيك. ومعادلة التفاعل كما يلي:
– يمتاز البولي إيثيلين بأنه غير قابل للذوبان في العديد من السوائل الشائعة نظراً لوزنه الجزيئي الكبير ومقاومته للهجوم الكيميائي وبذلك حل مكان الزجاج والفولاذ والألمونيوم في العديد من الاستخدامات .
– يبدأ تكوين البوليمر بجذر حر أو أيون يمكنه الإضافة إلى المونمر وتنشيطه ويعرف بإسم البادئ initiator حيث ترتبط الخواص الطبيعية للبولي إيثيلين (والبوليمرات الأخرى) بطول السلسلة أو متوسط الوزن الجزيئي كما يلي :-
(أ) إذا كان تركيز البادئ عالياً فأن العديد من سلاسل المبلمر تبدأ بالتكون مباشرة. وإذا كان تركيز البادئ منخفضا فأن عدد قليل من السلاسل يبدأ في التكون.
(ب) عند تساوي جميع العوامل وكان تركيز البادئ عالياً يتكون العديد من السلاسل القصيرة منخفضة الوزن الجزيئي. وإذا كان تركيز البادئ منخفضا فأنه يتكون عدد قليل من السلاسل الطويلة مرتفعة الوزن الجزيئي.
ملاحظات هامة:
– إن نسبة البادئ إلى المونمر هي العامل الرئيسي المتحكم بطول السلسلة في تفاعل البلمرة.
– يستمر تكوين السلاسل بإضافة وحدات إيثيلين متتابعة إلى أن يتوقف نمو السلسلة بالاتحاد مع سلسلة متشابهة أو بالتوزيع غير المتكافئ Disproportional في الجدول بعض الأمثلة على بوليمرات الإضافة كما يلي:
ثانياً / بوليمرات التكثيف Condensation Polymers
تختلف بوليمرات التكثيف عن بوليمرات الإضافة في انفصال جزئ ماء أو جزئ آخر صغير ( مثل الكحول) إلى جانب البوليمر.
(1) النايلون Nylon
ينتج من تفاعل حامض عضوي ثنائي القاعدية مع ثنائي أمين ويسمى بولي أميد.
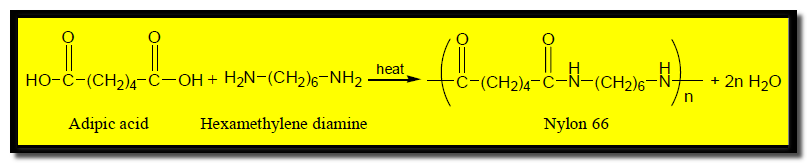
(أ) النايلون 66 – nylon 66
حيث يعتبر أكثر أنواع النايلون شيوعاً وهو الذي يتكون من البلمرة المشتركة لــــ Adipic acid مع المركب 1,6-Diamino hexane وكليهما يتكون من 6 ذرات كربون لذلك يسمى نايلون 66.
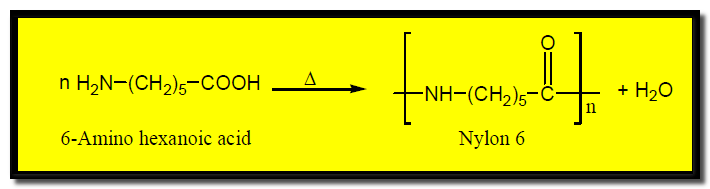
(ب) النايلون 6 – nylon 6
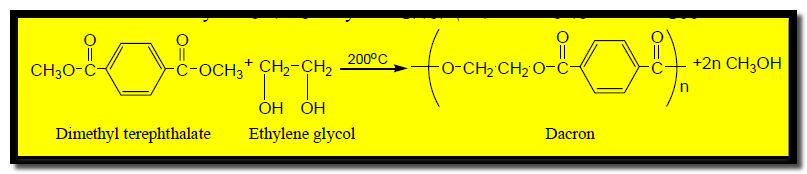
(2) الداكرون Dacron
ويعرف كذلك باسم تيريلين terylene أو مايلار Mylar