تفاعلات البنزين Benzene reactions
وفى هذا الموضوع سوف نسرد لكم جميع تفاعلات البنزين المشهورة
البنزين Benzene
– البنزين هو المركب الأساسي لعائلة المركبات الأروماتية الهيدروكربونية.
– الحلقة البنزينية مكونة من 6 ذرات كربون مرتبة بشكل سطحي على ستة زوايا لشكل سداسي منتظم ، وكل ذرة كربون متصلة بذرة هيدروجين.
– مركب البنزين له رنين لمركبين من أشكال كيكولي.
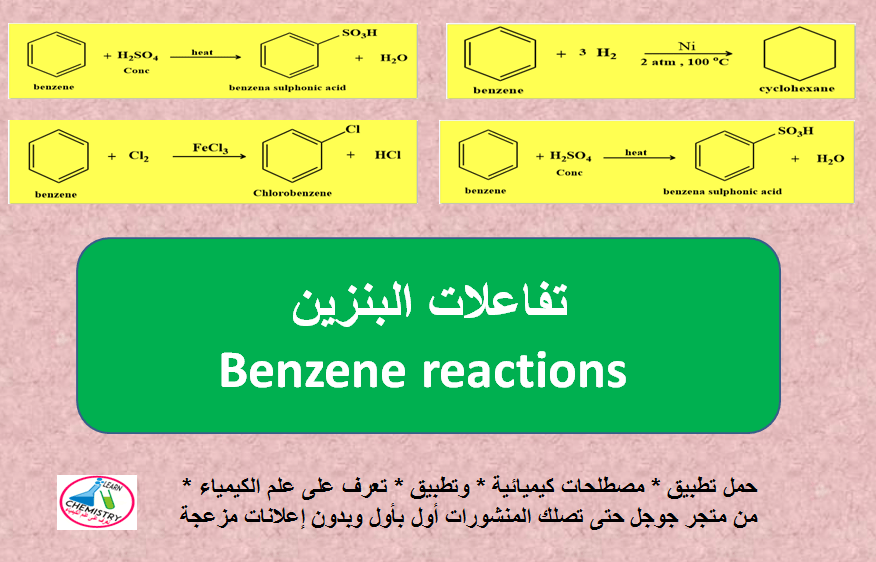
أولاً/ تفاعل الاحتراق Combustion reaction
يحترق البنزين مثله مثل جميع المركبات العضوية في وجود الهواء الجوي ويعطى ثاني أكسيد الكربون وبخار الماء ، و يشتعل بلهب مدخن في كمية محددة من الأكسجين نظراً لارتفاع نسبة الكربون فيه (6 ذرات كربون). ومعادلة التفاعل كما يلي:
ثانياً/ تفاعل الهدرجة Hydrogenation of benzene
يتفاعل البنزين مع الهيدروجين تحت ظروف خاصة من الضغط ودرجة الحرارة وفي وجود فلز النيكل او البلاتين الساخن فيتحول إلى هكسان حلقي. ومعادلة التفاعل كما يلي:
ثالثاً/ تفاعلات الأحلال الألكتروفيلي Electrophilic substitution reactions
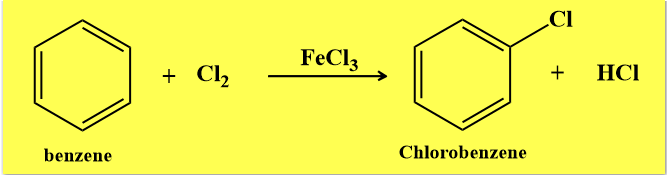
(1) تفاعل الهلجنة Halogenation
يتفاعل البنزين مع الكلور والبروم بسرعة في وجود حمض لويس مثل FeCl3 أو AlCl3 الذي يعمل على كسر الرابطة في جزئ الهالوجين لأن الكترونات باي في البنزين غير قادرة على ذلك لأنها تكون مشدودة بقوة نحو ذرات الكربون بسبب الرنين. ومعادلة التفاعل كما يلي:
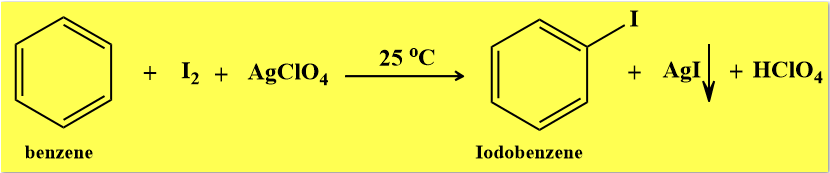
ولكي يتفاعل البنزين مع اليود يتم إضافة فوق كلورات الفضة لمخلوط التفاعل وذلك لضعف فاعلية اليود. ومعادلة التفاعل كما يلي:
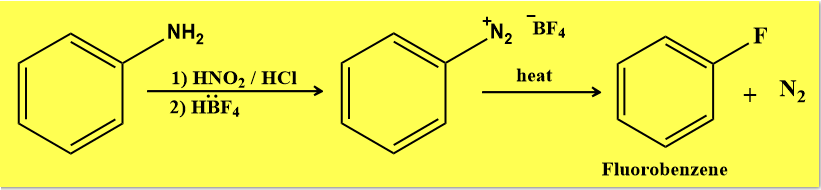
وبسبب فاعلية الفلور العالية فأنه يتفاعل مع البنزين بسرعة ويصعب التحكم في ناتج التفاعل عند الفلورة الأحادية لذا يتم الحصول على Fluorobenzene بطريقة غير مباشرة كما يلي :
(2) تفاعل النيترة Nitration
– هو عبارة عن تفاعل إدخال مجموعة نيترو NO2 على الحلقة.
– ويتم ذلك باستخدام مزيج النتيرة.
– وهو عبارة عن مزيج من حمض النيتريك وحمض الكبريتيك المركزين بنسبة (1:1) حيث يقوم حمض الكبريتيك بزيادة تركيز الألكتروفيل NO2+ ومنع حدوث التفاعل العكسي.
– معادلة التفاعل كما يلي:
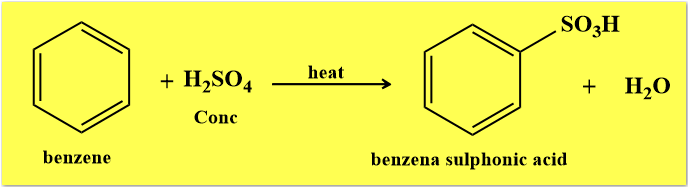
(3) تفاعل السلفنة Sulphonation
– هو عبارة عن تفاعل إدخال مجموعة السلفونيك SO3H على الحلقة.
– ويتم ذلك بالتفاعل مع حمض الكبريتيك المركز في درجة حرارة عالية أو باستخدام حمض الكبريتيك المدخن عند درجة حرارة معتدلة (حمض الكبريتيك المدخن هو الحمض الذي يحتوي على غاز SO3 ذائب فيه) .
– معادلة التفاعل كما يلي:
(4) ألكلة فريدل – كرافت Friedel-Crafts alkylation
أكتشف كل من الكيميائيين تشارلس فريدل Charles Friedel وجميس كرافت James M.Crafts سنة 1877م طريقة لإحلال مجموعة ألكيل ومجموعة الأسيل على حلقة البنزين حيث ترتبط المجموعتين كأليكتروفيل في وجود AlCl3 كحفاز. ومعادلة التفاعل كما يلي:
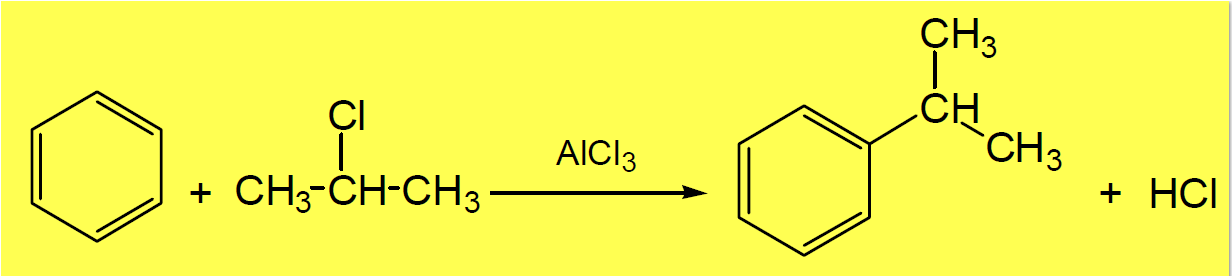
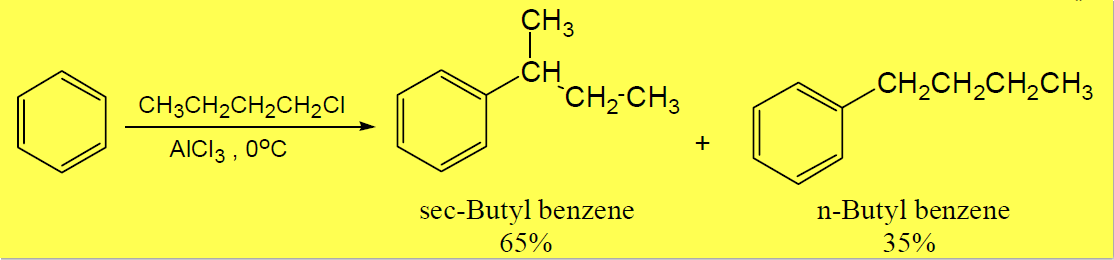
عيوب الأكلة فريدل – كرافت
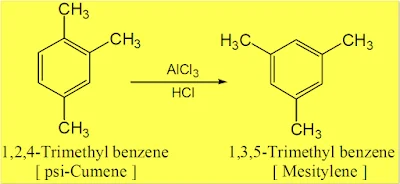
- حدوث الألكة المتعددة للبنزين حيث تعمل مجموعة الألكيل الدافعة للإلكترونات على تنشيط الحلقة تجاه الإلكتروفيل.
- لا تحدث تفاعلات فريدل – كرافت عند وجود مجموعات ساحبة للألكترونات على الحلقة.
- أحياناً تغير مجموعات الألكيل مواقعها على الحلقة.
- حدوث إعادة ترتيب للكاتيونات الكربونية أثناء تكونها بحيث يعتمد الناتج الرئيسي على الكاتيون الكاربونى الأكثر ثباتاً.
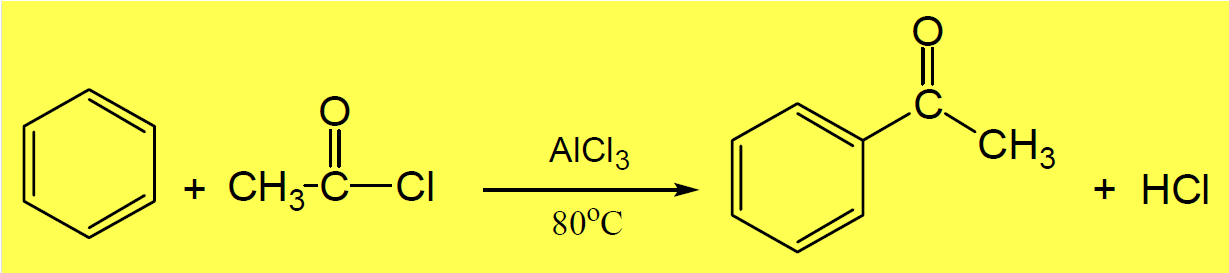
(5) أسيلة فريدل – كرافت Friedel-Crafts Acylation
شرح الموضوع بالفيديو
موضوعات هامة عن البنزين Benzene يمكنك أيضا قراءتها على موقعنا:
2- تسمية مشتقات البنزين Nomenclature of benzene derivatives
3 – 10 طرق لتحضير البنزين Ten Methods of Benzene preparation
4- تفاعلات البنزين Benzenereaction
5- تفاعلات مشتقات البنزين Reaction of benzene derivatives


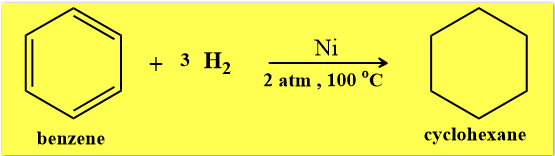
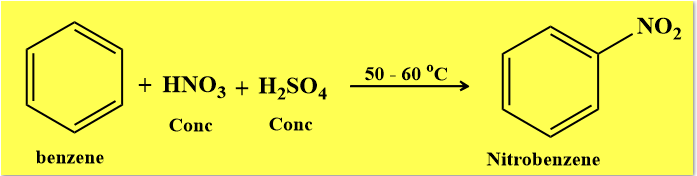



محتاج مصادر لتفاعلات المركبات العطريه