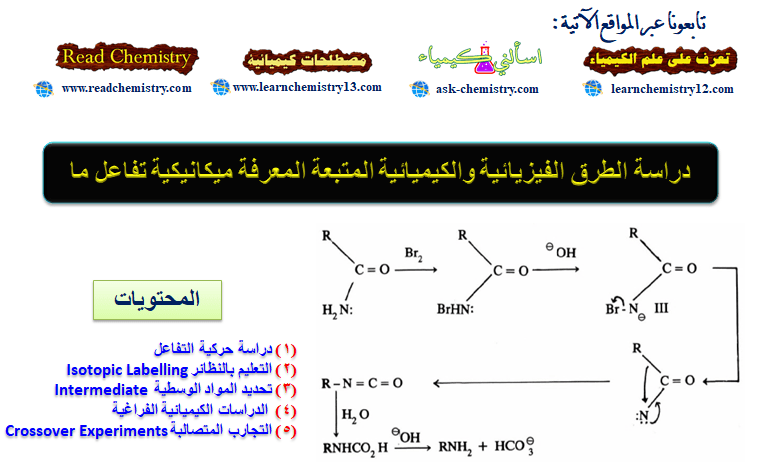
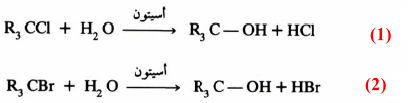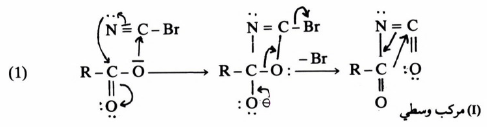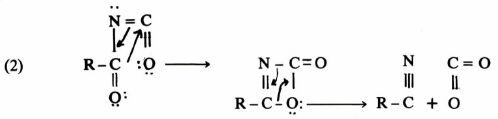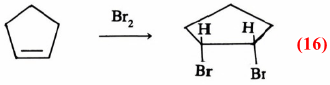التعرف على ميكانيكية التفاعل (آلية التفاعل)
دراسة الطرق الفيزيائية والكيميائية المتبعة لمعرفة ميكانيكية تفاعل ما
– إنه من غير الممكن أن نستطيع وضع تفصيل كامل حول تركيب ودراسة الشكل الفراغي والطاقي لمركب أثناء التفاعل الكيميائي. نظراً لأن ذلك يحتاج الكثير من العمل، فهناك التصور الميكانيكي النظري لسير هذا التفاعل.
– كما أن التجربة العملية أيضاً يجب أن تلازم التصور النظري ما أمكن وإلا يجب النظر من جديد إلى سير هذا التفاعل (ميكانيكة التفاعل)
– وعليه فإن هناك طرقاً مختلفة متبعة لمعرفة سير وميكانيكية التفاعل (آلية التفاعل) أهمها:
(1) دراسة حركية التفاعل
(2) التعليم بالنظائر Isotopic Labelling
(3) تحديد المواد الوسطية Intermediate Determination
(4) الدراسات الكيميائية الفراغية
(5) التجارب المتصالبة Crossover Experiments
وسوف نقوم بشرح كلاً منهما
أولاً/ دراسة حركية التفاعل لمعرفة ميكانيكية التفاعل
– إن دراسة ميكانيكية تفاعل كيميائي تقوم أكثر ما تقوم على المعلومات المستقاة من الدراسة الحركية. لكن ترجمة حركية التفاعل إلى ميكانيكية التفاعل ليس بالأمر البسيط.
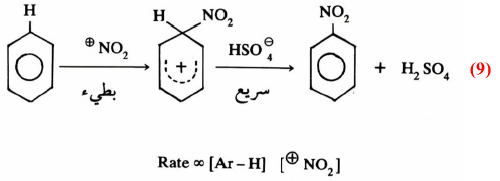
– فمثلاً نجد أن تركيز المواد المتفاعلة يلعب دوراً أساسياً، إذ يختلف عند بداية التفاعل عنه أثناء سير التفاعل . ففي عملية النيترة للمركبات العطرية نجد أن أيونات النيترونيوم NO3+ هي الأيونات المهاجمة. مع العلم بأننا نقيس تركيز حمض النيتريك HNO3 أثناء سير التفاعل والذي يضاف أصلاً عند بداية التفاعل.
ومن أهم الدراسات الحركية دراسة العلاقة القائمة بين سرعة التفاعل عند درجة حرارة معينة وتركيز المواد المتفاعلة. إذ أن تحديد نوع هذه العلاقة يعتبر جوهر الموضوع وتتأثر سرعة التفاعل بمتغيرات كثيرة مثل تغير درجة الحرارة ، التركيز ، المذيب. مما يعكس دلالات معينة عن ميكانيكية التفاعل.
فتعتمد الدراسة الحركية بصفة خاصة على معرفة سرعة أبطا خطوات التفاعل إذ أن هذه الخطوة البطيئة تحدد عموماً سرعة التفاعل الإجمالية، ولهذا كانت هذه الخطوة البطيئة بمثابة ممر حركي ضيق . وعليه فمعرفتنا لتركيز المواد المشاركة في هذه الخطوة البطيئة يمكننا من التعرف على درجة التفاعل.
ويسمى التفاعل من الدرجة الأولى First Order إذا اشترك فيه تركيز مادة واحدة. أما إذا اشترك تركيز مادتين أو ثلاث فإن درجة التفاعل تكون ثنائية أو ثلاثية .
أمثلة توضيحية
من أبسط الأمثلة على التفاعلات العضوية من الدرجة الأولى والتي يمكن إجراؤها بسهولة في المختبر تحلل هاليدات الألكيل الثالثية في وسط أسيتون مائي معادلتي (1 ، 2):
ويمكن تقدير الحمض معادلتي (1 ، 2): المتحرر خلال التفاعل. ومن ثم معرفة حركية التفاعل ومن هاتين المعادلتين نجد أن معدل سرعة التفاعل يعتمد على:
وتدل معادلة (3) على أن سرعة التفاعل تعتمد أساسا على تركيز هاليد الألكيل .
تتم معظم تفاعلات المركبات العضوية في المحاليل. وأي تغيير بسيط في المذيبات المستخدمة سوف يكون له أثر كبير على سرعة التفاعل وميكانيكيته. خاصة عندما تكون المادة الوسطية قطبية، مثل أيون الكربونيوم ، حيث يكون على شكل زوج أيوني (Ion pairs) ويكون أيون الكربونيوم محاطاً بهالة كبيرة من جزيئات المذيب والتي بالتأكيد تؤثر على درجة ثباته (أو على درجة تكونه) وبالطبع فإن تركيب المذيب وخاصة طبيعته القطبية ودرجة قدرته على الحل (lon solvating) . وبالعكس من ذلك فإن التفاعلات التي تتم على شكل جذر حر لا تتأثر تأثراً ملموساً عند تغيير المذيب إلا في الحالة التي يتفاعل فيها المذيب مع الجذر الحر.
ثانياً/ التعليم بالنظائر Isotopic Labelling
إن تعليم ذرة معينة في مركب ما بنظائر مشعة أو ثقيلة مهم في دراسة ميكانيكية التفاعل. حيث يمكن تتبع سير التفاعل من خلال متابعة هذه الذرة المشعة.
كذلك يمكن الاستفادة من التعليم بالنظائر عن طريق ملاحظة تأثير استبدال الذرات بنظائرها على سرعة التفاعل. هذا ويمكن الحصول على معلومات قيمة نتيجة للتعليم بالنظائر في كثير من التفاعلات العضوية التي يكتنف ميكانيكية تفاعلها الغموض.
فعلى سبيل المثال فإنه بالنظر إلى التحول في معادلة (4):
يتبادر إلى الذهن من الوهلة الأولى أن مجموعة الكربوكسيل (–R-COO) تم استبدالها بمجموعة السيانيد –CN من BrCN لكن باستخدام 14C في المركب المتفاعل أمكن إثبات أن الحقيقة عكس ذلك ، فعندما أعيد التفاعل من جديد على الصورة التالية:
ظهر أن الكربون المشع جاء أساساً من المركب الأصلي. وهذا جعل من السهل كتابة ميكانيكية التفاعل على النحو التالي:
وقد أمكن فصل المادة الوسطية (I) مما عزز صحة ميكانيكية التفاعل السابقة .
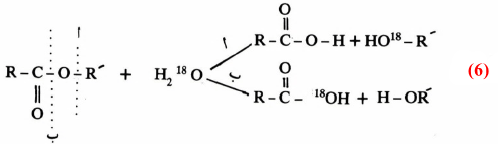
ومن الأمثلة المشهورة أيضاً على التعليم بالنظائر التحلل المائي للأستر (معادلة 6) وذلك عند استخدام H218O .
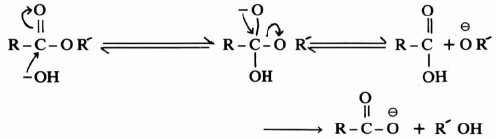
والتفـاعـل هنـا يمكن أن يسلك أحد طريقين( أ) أو (ب) ويمكن التحقق من الطريق الصحيح الذي سلكه التفاعل بدراسة طيف الكتلة للمركبات الناتجة من التفاعل (معادلة 6) حيث وجد أن الحمض المتكون يحتوي على الأكسجين – 18 أي أن التفاعل يتم بكسر الرابطة بين acyl-O (تفاعل ب)، ويمكن كتابة ميكانيكية التفاعل السابقة كالآتي :
ميكانيكية تفاعل كانيزارو Cannizzaro
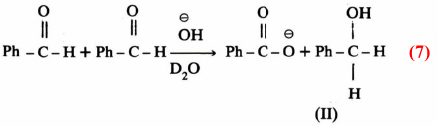
كما أنه يمكن معرفة ميكانيكية تفاعل كانيزارو Cannizzaro بإجراء التفاعل بنفس الطريقة السابقة، ففي تفاعل كانيزارو للبنزالدهيد Benzaldehyde مع هيدروكسيد الصوديوم في الماء الثقيل كمذيب .
وهنا يتبادر إلى الذهن السؤال التالي : من أين أتت ذرة الهيدروجين الثانية في مركب (Ph-CH2 – OH (II بنزيل الكحول، هل أتت من الماء أو من جزيء آخر من المادة المتفاعلة؟ .
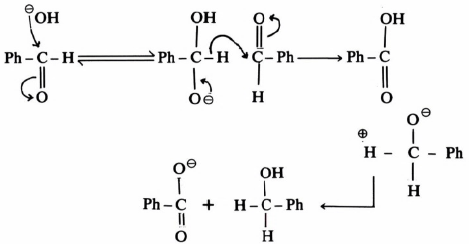
الإجابة على هذا الاستفسار يمكن الحصول عليها عند إجراء التفاعل في ماء ثقيل D2O فقد وجد أن المركب PhCHDOH لا يتكون، وهذا دليل قاطع على أن ذرة الهيدروجين الثانية في مركب (II) لم تأت من الماء المذيب ولكنها انتقلت من جزئ آخر من المادة المتفاعلة وتكون ميكانيكية التفاعل على النحو التالي :
وعنـد استخدام التعليم بالنظائر فإن الذرات المهمة في المركب هي التي يتم تعليمها فقط. أمـا تفاعلات التبادل (Exchange reactions) فلا يمكن دراستها إلا بطريقة التعليم بالنظائر (معادلة (8))
يمكن الاستفادة أيضاً من التعليم بالنظائر في التعرف على الرابطة المنكسرة أثناء الخطوة المحددة لسرعة التفاعل . فعند أكسدة Ph2CHOH إلى O=Ph2C بواسطة بيرمنجنات البوتاسيوم في وسط قاعدي، وجد أن Ph2CHOH يتأكسد بسرعة وبمقدار 6.7 مرة أسرع من Ph2CDOH حيث يتضح هنا أن استخدام نظير الهيدروجين (D) قلل من سرعة التفاعل وذلك لأن كسر الرابطة C-D أصعب من كسر C-H بحوالي 7 مرات عند درجة ٢٠مo.
يسمى التأثير السابق بالتأثير الحركي الأولي للنظائر ويدل على أن رابطة C-H تنكسر أثناء الخطوة المحددة لسرعة التفاعل. وعلى العكس من ذلك فإن عملية نيترة البنزين C6H6 أو C6D6 لها نفس معدل السرعة، مما يدل على أن كسر الرابطة بين C-H أو C-D لا يكون في الخطوة المحددة لسرعة التفاعل.
کما تستخدم طرق طيفية مثل NMR, IR وطيف الكتلة وقياس أشعة بيتا وغيرها للتعرف على التعليم بالنظائر.
ثالثاً/ تحديد المواد الوسطية Intermediate Determination
– إن أهم عنصر للدلالة على ميكانيكية تفاعل ما، هو حصولنا على دلالة قاطعة لإثبات تكون المادة الوسطية والتعرف عليها.
– وهناك خطوات مختلفة للتعرف على وجود المادة الوسطية والتعرف على تركيبها وأهمها :
(1) فصـل المادة الوسطية
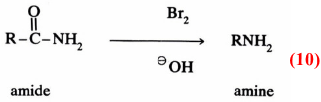
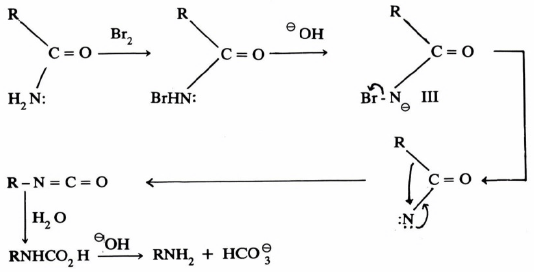
يمكن في بعض الأحيان فصل المادة الوسطية من خليط التفاعل وذلك بوقف التفاعل بعد فترة قصيرة أو بالتحكم في شروط التفاعل بحيث يتم تحت ظروف معتدلة ، وأوضح مثال على ذلك تفاعل خسف هوفمان حيث يتحول الأميد إلى أمين.
فقد استطاع الباحثون فصل المركبات الوسطية التالية:
(RCONHBr) N-bromoamide, (RNCO) isocyanate, RCONBr
وعليه تم معرفة ميكانيكية هذا التفاعل على أساس المكونات الوسطية السابقة.
ويجب عند التعرف على المواد الوسطية اتخاذ الاحتياطات اللازمة تحسباً بأن تكون هذه المواد ناتجة عن تفاعلات جانبية ويتم ذلك بفصل هذه المركبات الوسطية وإتمام التفاعل عليها تحت نفس ظروف التفاعل السابقة والتأكد من أن الناتج واحد في كلتي الحالتين.
ويمكن كتابة ميكانيكية تفاعل خسف هوفمان على النحو التالي:
إن الخطوة المحددة لسرعة التفاعل هي فقدان –Br من الأيون (III) ولكنه من المحتمل أيضاً أن يكون فقدان –Br وهجرة المجموعة –R في الوقت نفسه .
(2) التعرف على الحالة الوسطية بالطرق الفيزيائية
في كثير من الحالات لا يمكن فصل المادة المتكونة في الحالة الوسطية ولكنه يمكن التعرف عليهـا باستخدام طرق الطيف المختلفة مثل الطيف النووي المغناطيسي NMR وكذلك IR والطرق الأخرى المعروفة .
فمثلاً أمكن التعرف بواسطة طيف رامان Raman spectra)) أن أيون +NO2 هو الوسيط في عملية النيترة للبنزين كما أن تفاعلات الجـذور الحـرة يمكن التعرف عليها بواسطة الرنين المغـناطـيسي (Electron paramagnetic resonance (EPR.
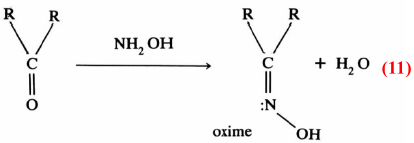
كما أنه يمكن الاستفادة من دراسة أطياف الأشعة تحت الحمراء IR . فعندما تتكون الأكسيمات مثلاً من مركبات الكربونيل المختلفة عند تفاعلها مع هيدروكسيل الأمين:
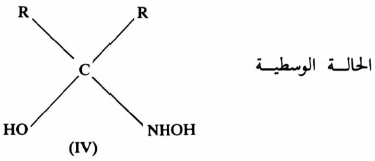
فقد وجد أن الحزم الطيفية الممتصة والخاصة بالرابطة O = C في المادة الأم تختفي بسرعة ونهائياً دون ظهور أية حزمة طيفية للدلالة على تكون C = N وعليه فلا بد أن تكون هناك حالة وسطية، تتكـون بسرعة ثم تتكسر ببطيء وهذا ما تم إثباته بالفعل (IV) . وبعد ذلك يتكون الأكسيم كناتج نهائي وتظهر خواص C= N بوضوح ويتكون الماء كما في معادلة (11):
(3) قنص المركبات الوسطية Traping of an intermediate compounds
قد يتعذر على الباحث فصل المادة الوسطية لسرعة التفاعل أو عدم ثباتها .کما يتعذر التعرف عليها من خلال دراسة الأطياف لخليط التفاعل.
ولإثبات تكون المادة الوسطية فإنه يمكن إضافة مادة تتفاعل مع تلك المادة الوسطية المتوقعة وعليه يمكن قنصها والتعرف عليها .
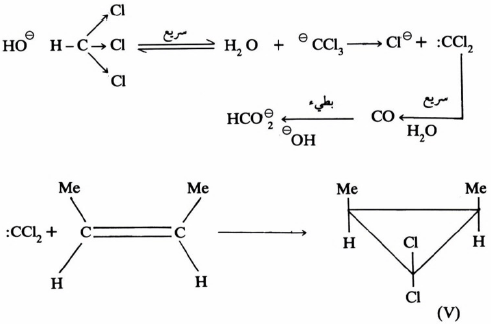
فعلى سبيل المثال فإنه في عملية التحلل للكلوروفورم بوجود قاعدة قوية يتكون مركب وسطي عبارة عن كلوروكربين CCl2 : وهو مركب نشط وعنده نقص شديد في الإلكترونات (Electron-deficient) لذلك يمكن قنصه بسهولة عند إضافة مركب غني بالإلكترونات مثل (cis-but-2-ene) إلى خليط التفاعل حيث يتكون البروبان الحلقي (V) نتيجة لهذا التفاعل.
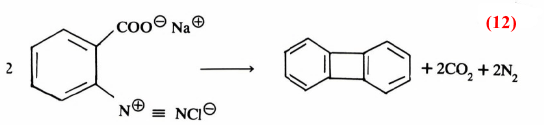
كما أن هناك أمثلة أخرى تبين لنا أهمية المادة الوسطية وكيفية اقتناصها فمثلاً يمكن تحضير مركب Biphenylene من دستزة (Diazotization) ملح حمض الانثرانيل (معادلة 12)
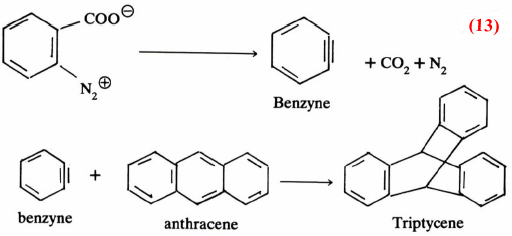
ومن تصورنا لميكانيكية هذا التفاعل نجد أن مثل هذا الناتج يمر بمرحلة وسطية يتكون خلالها البنـزاين (C6H4 ( Benzyne وهـو مركب غير ثابت، يمكن اقتناصه بسهولة . وذلك بتفاعله مع الانثراسين، حيث يتكون التريبتايسين (Triptycene) ومثل هذا التفاعل يسمى بتفاعل ديلز – الدر (Diels-Alder) (معادلة 13)
وهذا يثبت أن البنزاين يتكون كمادة وسطية عند تحضير مركب Biphenylene (معادلة 999)
رابعاً/ الدراسات الكيميائية الفراغية لمعرفة ميكانيكية التفاعل
يمكن الاستفادة من بعض التفاعلات التي تكون لها خاصية فراغية معينة لاسيما قدرتها على حرف (انحراف) الضوء المستقطب المار خلالها.
تعطي دراسة نواتج هذه التفاعلات إذا ما قورنت بالمـواد قبل التفاعلات بالنسبة لقدرتها على حرف الضوء المستقطب إشارة واضحة لميكانيكية التفاعل.
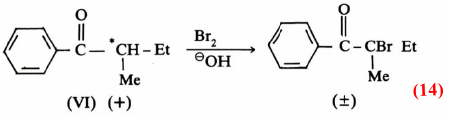
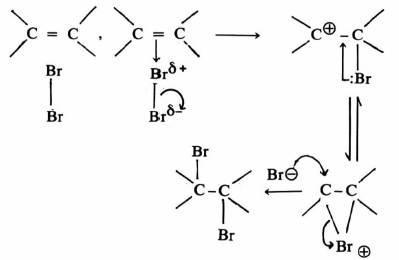
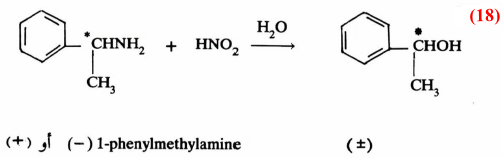
فعلى سبيل المثال إن عملية برومة مادة فعالة ضوئيا (+) مثل (VI) في وجود حافز كالقاعدة يتكون الكيتون الذي يتصف بأنه غير فعال. بمعنى أنه لو بدأنا بمادة تحرف الضوء المستقطب نحو اليمين (+) أو نحو اليسار (-) فإن المادة الناتجة لا تؤثر على الضوء المستقطب (± ) بمعنى تكون خليط راسيمي ، كما هو واضح من معادلة (14):
وتدل النتيجة السابقة على أن المادة الوسطية لا بد وأن تكون على شكل مستوى (سوف نقوم بتفصيل ذلك خلال تفاعلات الاستبدال بنوعيه فيها بعد) تتم مهاجمته بالعـامـل النيكليوفيلي من الأمام والخلف بنفس المقدار مما يؤدي إلى تكون الخليط الـراسيمي غير الفعال.
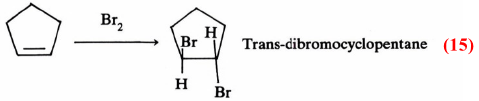
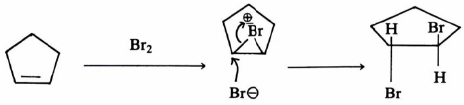
كذلك يمكن شرح تفاعل البروم مع السيكلوبنتين بنفس الطريقة السابقة حيث يتكون trans-dibromocyclopentane معادلة (15)
وهذا ينفي إضافة البروم إلى الرابطة الزوجية من اتجاه واحد. وتكون سز ـ ثنائي برومو سيكلو Cis-dibromocyclopentane معادلة (16)
وعليه فإن ميكانيكية التفاعل الأول (معادلة 15) تتم بخطوتين كالتالي:
مثال: (معادلة 14)
وهناك أمثلة عديدة نذكر منها الأمثلة التالية:
خامساً/ التجارب المتصالبة Crossover Experiments لمعرفة ميكانيكية التفاعل
يستخدم هذا النوع من التجارب للدلالة على تحول أو هجرة بعض المجاميع أو الذرات من مكانها الأصلي إلى مكان جديد في المركب الناتج. حيث يتم ذلك بانشطار هذه المجمـوعـة عن المادة المتفاعلة انشطاراً تصبح فيه حرة وهذا ما يسمى بالتحول الموضعي بين الجزيئات (Intermolecular rearrangement) . أو يتم بتحول المجموعة (Intermolecular rearrangement) .
ولكي نبرهن على صحة مثل هذه التفاعلات فلابد من إجـراء التفاعل على مزيج من جزيئين متشابهين لكنها غير متطابقين تماماً ثم يحلل المزيج الناتج من التفاعل وبذا يمكن معرفة فيها إذا تم التفاعل ضمن الجزيء نفسه أو بد من إجراء التفاعل على مزيج من جزيئين متشابهين لكنها غير متطابقين تماماً ثم يحلل المزيج الناتج من التفاعل وبذا يمكن معرفة فيها إذا تم التفاعل ضمن الجزء نفسه أو اشترك فيه جزيئان .
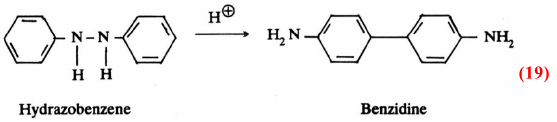
ومن الأمثلة المعروفة لدينا هو التحول الموضعي في الجزيء الذي يخضع له مركب الهيدرازوبنزين Hydrazobenzene في وسط حمضي. إذ ينشأ مركب البنزيدين Benzidine. وهو ما يعرف بتفاعل التحول الموضعي للبنزيدين:
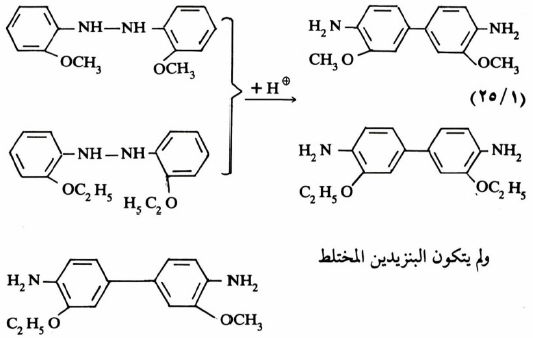
وقد أجرى التفاعل على مزيج من مركبين متشابهين. وعند تحليل النواتج وجد أن هناك ناتج بنزیدین متجانس. ولم ينشأ بنزیدین مختلط كما هو واضح من المثالين الآتيين :
وعليه فإن حادثة التحول الموضعي تتم في الجزيء نفسه. حيث يتم الارتباط أولاً ثم الانشطار يعقبه التحام حلقتي البنزين قبيل انشطار الرابطة N-N
المراجع:
كتاب ميكانيكية التفاعلات العضوية ، تأليف/ د.سالم بن شويهان ، د. إبراهيم بن محمود النجار ، د. حمد بن عبدالله اللحيدان ، الرياض – جامعة الملك سعود – الطبعة الثانية 2003م