الكيمياء العضوية
انهيدريدات الاحماض الكربوكسيلية Acid Anhydrides (موضوع شامل)

تعريف انهيدريدات الأحماض Acid Anhydrides
– تعتبر انهيدريدات الأحماض Acid Anhydrides من مشتقات الأحماض الكربوكسيلية وذلك لأنه عند التحلل المائي لانهيدريدات الأحماض فأنها تعطي أحماضاً كربوكسيلية.
– تعتبر الانهيدريدات أو انهيدريدات الأحماض إحدى مشتقات الأحماض الكربوكسيلية وتأتي بعد كلوريدات الأحماض من حيث الفاعلية Reactivity
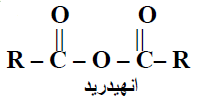
– المجموعة الوظيفية لأنهيدرات الأحماض هى مجموعتين من الأسيل Acyl group يفصلهما ذرة أكسجين.
تسمية أنهيدريدات الأحماض Nomenclature of Acid Anhydrides
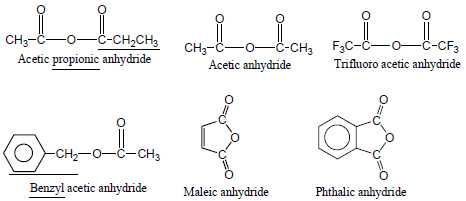
– يتم تسميتها باستبدال كلمة acid من اسم الحمض الكربوكسيلي المقابل بكلمة anhydride وذلك في حالة الأنهيدريدات المتناظرة أو الأنهيدريدات التي تنتج من نزع جزئ ماء من الأحماض الكربوكسيلية ثنائية القاعدية.
– أما عندما تنتج الانهيدريد من حمضين مختلفين فأنه يتم تسمية الحمضين المكون منهما ثم يتبع بكلمة anhydride
أمثلة:
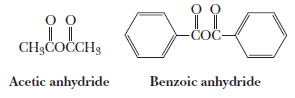
الطرق العامة لتحضير انهيدريدات الأحماض Acid Anhydrides
General Methods of Preparation of Acid Anhydrides
يمكن استخدام إحدى الطرق التالية لتحضير انهيدريد معين:
(1) من جزيئي حمض كربوكسيلي Two molecules of Carboxylic acid
تتكون الانهيدريدات يفقد جزئ ماء عند تسخين جزيئين من حمض كربوكسيلي:
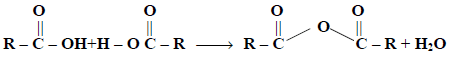
ويمكن أن تكون الانهيدريد المتكونة متماثلة إذا كان الجزيئان متماثلان ، أو غير متماثلا ن عند استخدام حمضين مختلفين ويستثنى من ذلك حمض الفورميك حيث يتحلل عند التسخين إلى CO
(2) من تفاعل كلوريد حمض مع ملح صوديومى لحمض
Reaction between Acid Chlorides and Sodium salt of an acid
يتم تقطير مخلوط من ملح صوديومي لحمض (مثل اسيتات الصوديوم اللامائي المنصهر) وكلوريد حمض (مثل كلوريد اسيتيل) ليعطي انهيدريد الخليك.
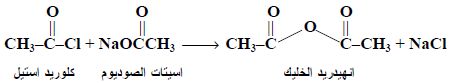
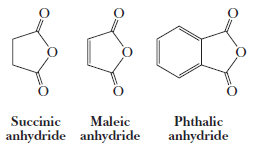
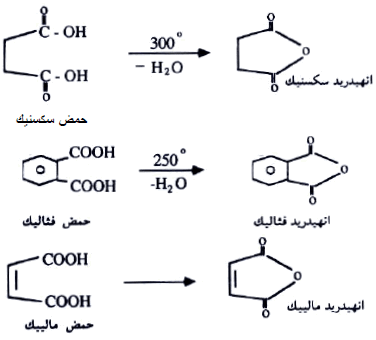
(3) تحضير الانهيدريدات الحلقية Preparation of cyclic acid anhydrides
تحضر الانهيدريدات الحلقية بتسخين أحماض ثنائية الكربوكسيل (أحماض اليفاتية أو اروماتية):
تحضير بعض أنهيدريدات الأحماض الهامة
(1) أنهيدريد الأسيتيك Acetic anhydride
يستخدم هذا الأنهيدريد يشكل موسع ويحضر في الصناعة بأحدي الطريقتين:
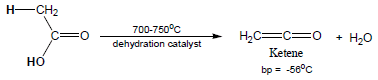
(أ) الطريقة الأولي
– يتم نزع جزئ ماء من حمض الخليك فينتج Ketene كما يلي:
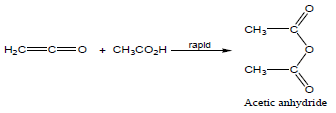
– ثم يتفاعل Ketene مع جزئ آخر من حمض الخليك الذي يضاف للرابطة C=C الثنائية بإضافة تتبع قاعدة ماركونيكوف فينتج انهيدريد الأستيك.
(ب) الطريقة الثانية
بتمرير الاستيلين إلى حمض الخليك الذي يحتوي على كمية بسيطة من خلات الزئبق وحمض الكبريتيك
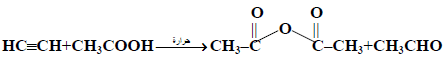
(2) أنهيدريد سكسنيك Succinic anhydride
يحضر من تسخين حمض السكسنيك
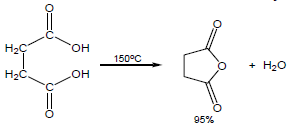
(3) أنهيدريد الماليك Maleic anhydride
يحضر بالأكسدة القوية للبنزين في وجود أكسيد الفناديوم الساخن
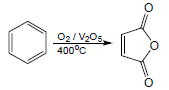
ملحوظة: لا يحضر formic anhydride بالطرق العادية لأنها مركبات غير مستقرة
HCOOH
+ H2SO4 → H2O + CO
+ H2SO4 → H2O + CO
الخواص الفيزيائية لانهيدريدات الأحماض Physical properties of Acid Anhydrides
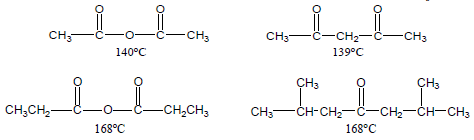
– نجد أن انهيدريدات الأحماض الأولى تكون سوائل لها روائح نفاذة ، فانهيدريد الخليك تغلي عند درجة حرارة 139Co وتذوب في الماء بحوالي 12% وهي أهم انهيدريد وأكثر استخداماً في المختبرات.
– لأنهيدريدات الأحماض درجات غليان مقاربة لدرجات غليان الألدهيدات والكيتونات المقابلة لها فى الوزن الجزئيي
فعالية انهيدريدات الأحماض Reactivity of Acid Anhydrides
– تعتبر الانهيدريدات أو انهيدريدات الأحماض إحدى مشتقات الأحماض الكربوكسيلية وتأتي بعد كلوريدات الأحماض من حيث الفاعلية Reactivity
– الانهيدريدات مواد ذات فاعلية كبيرة ، يمكنها التفاعل مع الماء والكحولات والأمينات شأنها شأن كلوريدات الأحماض ، ولكنها أقل منها فاعلية . ويلاحظ أن أحد النواتج الجانبية لتفاعلات انهيدريد الخليك مع الكواشف الأخرى هو حمض الخليك.
الخواص الكيميائية انهيدريدات الأحماض Chemical properties of Acid Anhydrides
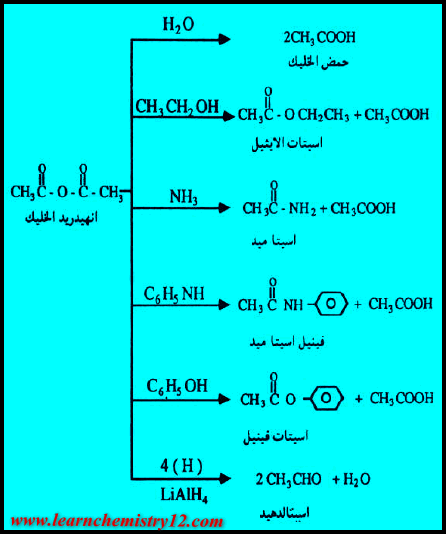
(1) التحلل المائي Hydrolysis of Acid Anhydrides
– تتحلل الأنهيدريدات مائياً وتنتج الأحماض الكربوكسيلية المتكونة منها . ولهذا السبب فهي تسمى مشتقات الأحماض الكربوكسيلية.
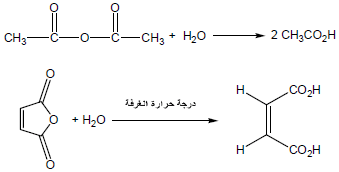
– يمكن أن يتحلل الأنهيدريد حمضياً مع HCl إلى حمض كربوكسيلي وكلوريد الحمض كمايلي:
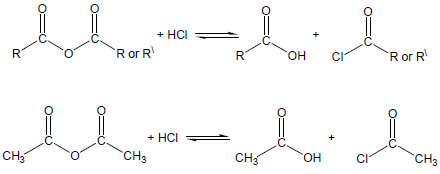
(2) التفاعل مع الكحولات Reaction with alcohols
تتفاعل الكحولات مع انهيدريدات الأحماض لتعطي الأسترات
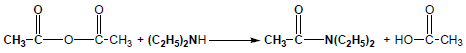
(3) التفاعل مع الأمينات Reaction with Amines
هو تفاعل تحضير الأميدات حيث تتفاعل انهيدريدات الأحماض مع الأمينات لتعطي الأميدات
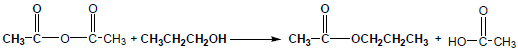
(4) تفاعل الاختزال Reduction of Acid Anhydrides
تختزل انهيدريدات الأحماض إلى الدهيدات ثم إلى كحولات أولية كما يلي :-
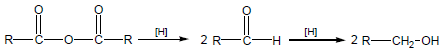
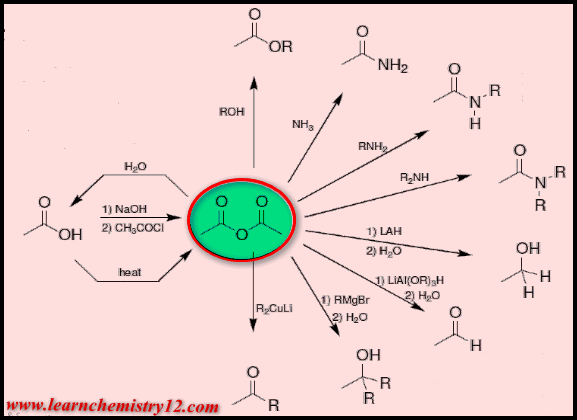
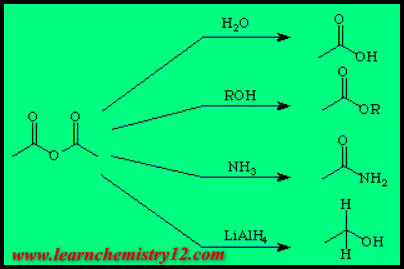
مخطط تفاعلات انهيدريدات الأحماض Acid Anhydrides
يمكن تمثيل تفاعلات الانهيدريدات باستخدام انهيدريد الخليك كمثال على ذلك :
تمارين محلولة على انهيدريدات الاحماض الكربوكسيلية Acid Anhydrides
تمربن (1): ماهو ناتج تفاعل Acetic anhydride مع كل من المركبات الأتية؟
(a) 3-Pentanol
(b) Acetic acid
الحل:
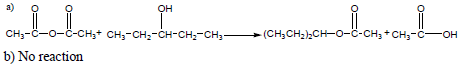
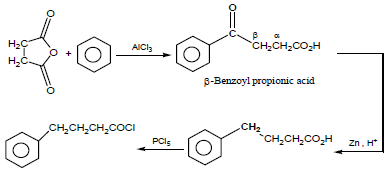
تمرين (2): كيف تحول Succinic anhydrideإلى كل من المركبين التاليين؟
(a) 4-Phenyl butanoyl chloride
(b) Tetralone
الحل:
(a)
(b)
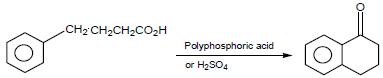
المراجع :
– أسس الكيمياء العضوية . وائل غالب محمد – وليد محمد السعيطي ، الطبعة الأولى (2008) / دار الكتب الوطنية – بنغازي – لبيبا
– أساسيات الكيمياء العضوية. محمد مجدي واصل ، جامعة الأزهر – جمهورية مصر العربية
Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition) . United States
– أساسيات الكيمياء العضوية. محمد مجدي واصل ، جامعة الأزهر – جمهورية مصر العربية
Organic chemistry / William H. Brown , Christopher S. Foote , Brent L. Iverson , Eric V. Anslyn , Bruce M. Novak . ( sixth edition) . United States