تجربة تحضير أملاح الدايزونيوم فى المعمل Diazonium Salts
محتويات الموضوع
تجربة تحضير أملاح الدايزونيوم Preparation of Diazonium Salts
– يتم تحضير أملاح الدايزونيوم Diazonium Salts دستزة الأمينات الاروماتية Diazotization of Amines Aromatic وسيتم مناقشة الجزء النظري والعملى لهذة التجربة.
أولاً/ الجزء النظري لتجربة تحضير أملاح الدايزونيوم
– تتفاعل كل أصناف الأمينات الأليفاتية والآروماتية مع حامض النتروز في ظروف حامضية خاصة ودرجات حرارية واطئة لتعطي نواتج مختلفة حسب نوع الأمين.
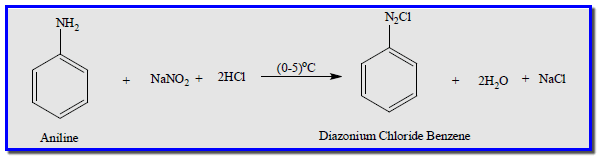
– الحمض المستعمل HNO2 مركب غير مستقر يحضر آنيا إثناء الاستعمال من تفاعل نتريت الصوديوم مع أي حمض معدني مثل HCl وكما في المعادلة التالية:
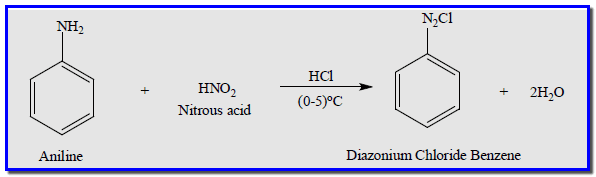
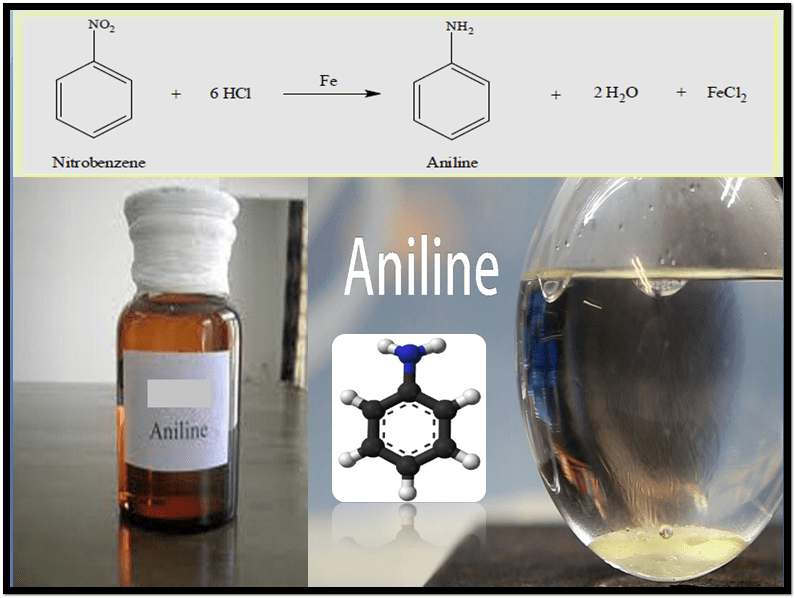
– عند تفاعل الأمين الآروماتي الأولي مثل الانيلين مع حامض النتروز البارد وفي محلول حمض HCl كعامل مساعد تعطي كلوريد الدايزونيوم اريل أو كلوريد الدايزونيوم بنزين.
– ملاحظة: هذه المركبات فعالة جداً لذلك يجب إجراء التفاعل مع التبريد عند الظروف الصفر المئوي تقريباً.
المعادلة العامة لتحضير أملاح الدايزونيوم فى المعمل
المعادلة التالية هى المعادلة العامة لتحضير أملاح الدايزونيوم فى المعمل كما يلي:
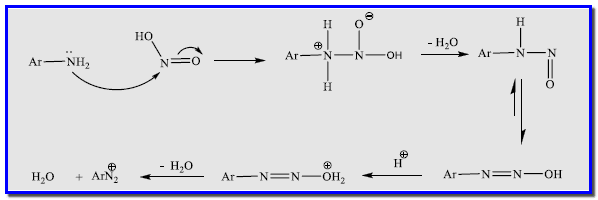
ميكانيكية التفاعل
الشكل التالي يوضح ميكانيكية التفاعل لتحضير أملاح الدايزونيوم فى المعمل كما يلي:
– إن أملاح الدايزونيوم الاليفاتية فعالة أكثر من أملاح الدايزونيوم الآروماتية بحيث تكون غير مستقرة حتى في الظروف الباردة. لماذا؟
– بصورة عامة أملاح الدايزونيوم الاليفاتية تكون غير ثابتة تتحول إلى الكحولات المقابلة والى مركبات مختلفة حسب نوع الأمين الاليفاتي المستخدم لذلك فهي ليست لها أي فائدة صناعية وذلك لتحللها السريع وتفككها.
تفاعلات أملاح الدايزونيوم
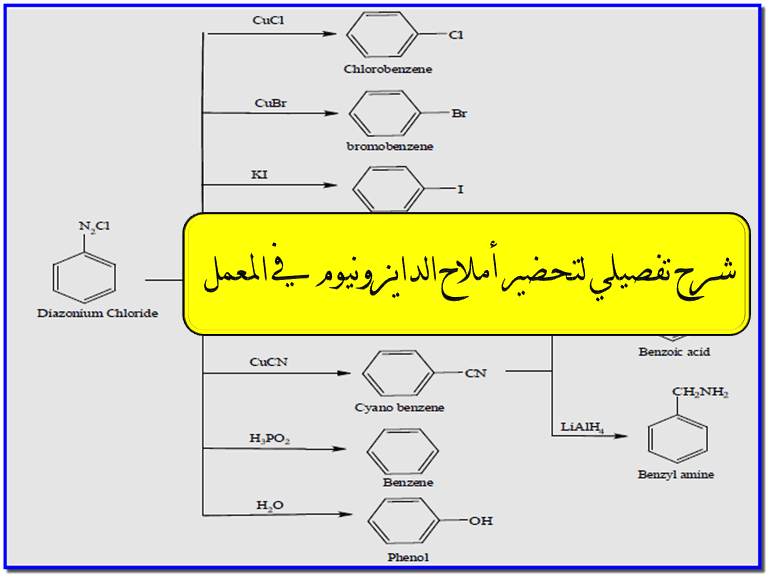
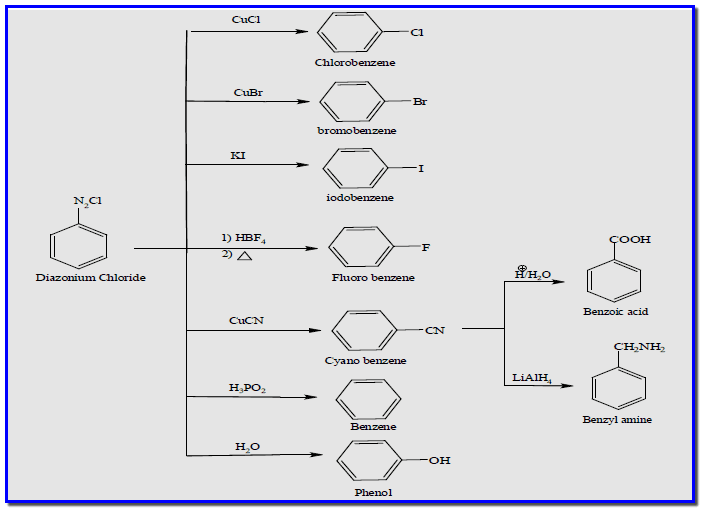
(1) تفاعلات الاستبدال Substitution Reaction
هي تفاعلات استبدال نيوكلوفيلية تستبدل مجموعة الدايزونيوم بنيوكلوفيل مختلف، وهي مبينة بالمخطط كما يلي:
(2) تفاعلات الازدواج Coupling Reaction
– عند إضافة الفينولات أو الأمينات الآروماتية إلى محلول متعادل أو قلوي من أملاح الدايزونيوم يحدث تفاعل ازدواج مع الاحتفاظ بالنتروجين ،والنواتج هي مركبات آزو هي تحتوي على مجموعة آزو -N=N-
– مركبات الآزو ملونة والكثير منها يمكن استخدامه كأصباغ.
ثانياً/ الجزء العملي لتجربة تحضير أملاح الدايزونيوم
الأدوات والمواد الكيميائية المطلوبة
الأجهزة والأدوات
– يتم توفير الأدوات الآتية كما يلي:
- بيكر
- دورق مخروطي
- اسطوانة مدرجة
- ميزان حرارة
المواد الكيميائية المطلوبة
– يتم توفير المواد الكيميائية الآتية كما يلي:
- الأنيلين
- نتريت الصوديوم
- حمض HCl المركز
- مسحوق الثلج
خطوات التجربة
(1) أذب 2ml من الأنيلين في مزيج من 7ml حمض HCl المركز مع 7ml من الماء في دورق مخروطي.
(2) ضع ترمومتر في المحلول واغمر الدورق في حمام من مسحوق الثلج, برد مع التحريك حتى تصبح درجة الحرارة تحت 5Co
(3) أذب 1.6g من نتريت الصوديوم في 8ml من الماء وبرد المحلول بغمره في الحمام الثلجي.
(4) أضف محلول نتريت الصوديوم بعدة دفعات (1-2ml لكل دفعة) إلى محلول هيدروكسيد الانيلين البارد وحرك بالترمومتر ، تتحرر حرارة نتيجة التفاعل ويجب أن لا ترتفع درجة الحرارة فوق 5Co (أضف بضعة جرامات من الثلج إلى مزيج التفاعل عند الضرورة).
(5) احتفظ بالمحلول إذا أردت استخدامه فى تفاعلات وتجارب أخري )يحفظ عند صفر مئوي في حمام ثلجي(.
تعليمات السلامة داخل المختبر الكيميائي
يجب عليك قبل بدء التجربة مراعاة التعلميات الآتية كما يلي:
(1) يجب مراعاة نظافة المختبر والأدوات المستخدمة به.
(2) يجب عدم إلقاء المواد الكيماوية بالأحواض إلا بعد تخفيفها. ولا يجوز نهائيا إلقاء قطع أو قشور الصوديوم في الأحواض.
(3) كما يجب أن تكون الأرضيات وكذلك أسطح الطاولات من مواد مقاومة للحريق والمواد الكيماوية وسهلة التنظيف.
(4) يجب غسل الأواني التي بها بقايا مواد سريعة الاشتعال بعد انتهاء العمل بها.
(5) يجب عدم تخزين الكيماويات أو عينات المواد المراد حفظها داخل المختبر إلا بأقل قدر ممكن ولحاجة العمل فقط.
(6) كما يجب عدم حفظ السوائل السريعة التبخر إلا في الثلاجات. ويجب الانتباه عند تغطية زجاجات الكيماويات.
(7) يجب وضع إناء مملوء بالرمل تحت القناني التي لا يوجد سبيل آخر لحمايتها. واعلم أن استخدام الرمال والتراب لامتصاص الأحماض المنسكبة على الأرض من الوسائل الآمنة من وجهة نظر السلام.
(8) عند تسخين مواد سريعة الاشتعال يجب استخدام حمام مائي.
(9) لا تحاول أن تدخل بقوة أنبوبة في سدادة فلين أو مطاط. بلل الزجاج بالماء أو الزيت أولاً لان ذلك يسهل ألي حد كبير هذه العملية.
أحتياطات أخرى
(10) يجب تداول المواد الخطرة حسب الأسس العلمية. وكمثال عند تخفيف حمض الكبريتيك فأن الحمض يضاف للماء ولا يضاف الماء إليه.
(11) يجب عدم استخدام المواد الخطرة كالفوسفور إلا تحت الإشراف الفعلي لمسئول المختبر. ومراعاة حفظ الفوسفور الأبيض والأصفر تحت سطح الماء لمنع اشتعالها تلقائياً حيث إنها تشتعل بمجرد تعرضها للهواء.
(12) كما يجب أن يكون بكل مختبر أكثر من مخرج. ويفضل أن تكون الأبواب من النوع المفصلي التي تفتح للداخل والخارج.
(13) يجب أن يتأكد محضر المختبر من فصل الكهرباء وإغلاق الغاز والماء عند انتهاء العمل بالمختبر يومياً ما لم يكن هناك أجهزة تلزمها الكهرباء باستمرار مثل الثلاجات أو أجهزة تكييف الهواء لظروف معينة.
(14) يجب على محضر المختبر إجراء التفتيش الدوري على توصيلات الغاز والمياه والمجاري والكهرباء للتأكد من سلامتها والإبلاغ عن أي خلل بها فور اكتشافه.
(15) كما يجب على محضر المختبر التأكد من توفير التهوية المناسبة والإضاءة المناسبة بالمختبر.
(16) يجب التأكد من أن غرفة الغازات (غرفة التجارب) محكمة الغلق لمنع تسرب الغازات الضارة منها أثناء إجراء التجارب الخطرة وأن تكون مزودة بمروحة سحب مناسب.
المراجع: تجارب فى الكيمياء العضوية. أسعد هاشم عنيد – حيدر مصطفي كمال – نهي سلمان صالح – أحمد حسون مجيد ، الطبعة لأولى (2015م) / جامعة الكوفة – كلية العلوم – العراق





ما هي فائده الهيدروكلوريك في تجربه تحضير ملح الدايزونيوم
اكثر من وظيف
– كعامل مساعد
– لكي يكون الوسط حامضي
– لاعطاء الملح من خلال منح الكلوريد
لماذا يحضر حامض النتروز بصوره انيه
لان مركب غير مستقر وقلق جدا لذا يجب تحضيره انيا بالمختبر
لماذا يستخدم محلول قاعدي من هيدروكسيد الصوديوم مع الفينول في تحضير اصباغ ألأزو بينما يستخدم محلول حامضي في حاله استخدام ألأمينات في تحضير اصباغ ألأزو
ان الامينات الاروماتيه الاوليه هي الوحيده التي تكون املاح الدايزونيوم ؟