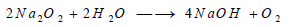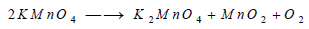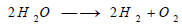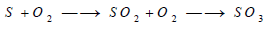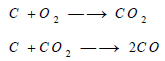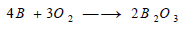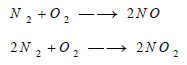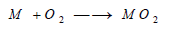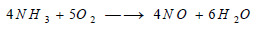عنصر الأكسجين Oxygen (اكتشافه – تحضيره – خواصه – استخداماته)
أولاً/ ما هو عنصر الأكسجين Oxygen ؟
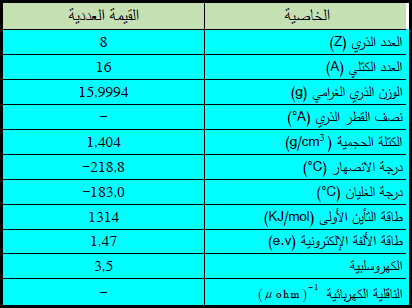
– الأكسجين Oxygen هو أحد أهم العناصر الكيميائية الموجودة في الجدول الدوري للعناصر ، العدد الذري = 8، العدد الكتلي = 16
– التوزيع الإلكتروني لعنصر الأكسجين: , 2P4 1S2, 2S2
– الأكسجين Oxygen ينتمي إلى عائلة الكالكوجينات Chalcogensالمكونة للمجموعة 16 في الجدول الدوري.
– يكون الأكسجين الحر في درجات الحرارة والضغط الاعتيادية، غازاً لا لون له ولا رائحة ولا طعم وله خواص مغناطيسية.
– يشكل الأكسجين Oxygen عند اتحاده مع عناصر أخرى تشكيلية متنوعة من المركبات، وأكثر هذه المركبات أهمية الماء.
– يوجد الأكسجين Oxygen في الطبيعة بشكل جزيئه ثنائية الذرة O2 وتعتبر هذه الجزئية ثابتة، ولكي تتفكك إلى ذراتها يجب تسخينها إلى ما فوق الدرجة 2000 Co
– الجدول التالي يوضح بعض الخواص العامة لعنصر الأكسجين Oxygen:
ثانياً/ اكتشاف الأكسجين Oxygen ووجوده في الطبيعة
– أكتشف وجود غاز الأكسجين عام 1771 م بواسطة الكيميائي السويدي (شيل (Scheele ووصفه بأنه غاز تتوهج فيه الأجسام المشتعلة.
– حضر الأكسجين العالم الإنجليزي “بريستلي Priestley عام 1774م بتسخين أكسيد الزئبق. وأطلق عليه Lavoisier) لافوازيية) بعد ذلك اسم الأكسجين حيث (Oxy) تعني حمض و (genes) تعني مولد أي مولد الحمض .
– يعد الأكسجين من أكثر العناصر انتشاراً على سطح الكرة الأرضية.
– يشكل الأكسجين 21% من حجم الهواء. وتبقى هذه النسبة ثابتة في الجو نتيجة لعملية التمثيل اليخضروري، حيث عند تعرض النباتات الخضراء إلى أشعة الشمس تأخذ من ثنائي أكسيد الكربون ومن التربة الماء وتشكل المركبات الهيدروكربونية وتطلق الأكسجين.
–ويشكل الأكسجين حوالي 50%من وزن القشرة الأرضية، فهو العنصر الأول فيها.
– يشكل الأكسجين حوالي 89%من وزن الماء.
– يعتبر الأكسجين من العناصر الأساسية في كافة المواد العضوية، بالإضافة إلى الكربون والهيدروجين والآزوت، وهو العنصر الأساسي في عمليات التنفس والاحتراق.
– يوجد في الطبيعة على شكل مزيج مؤلف من ثلاثة نظائر وهي:
(أ) النظير O16 بنسبة 99.76 %
(ب) والنظير O17 بنسبة 0.039 %
(جـ) النظير O18 بنسبة 0.2 %
ثالثاً/ تحضير الأكسجين Oxygen
يحضر الأكسجين مخبرياً بعدة طرق مختلفة وأهمها:
(1) التفكك الحراري لبعض أكاسيد المعادن المنخفضة في السلسلة الكهروكيميائية
تكون معظم الأكاسيد المعدنية ثابتة تجاه الحرارة. ولكن أكاسيد المعادن ذات الكمون المنخفض في سلسلة كمونات المساري، كالزئبق والفضة تكون غير ثابتة حرارياً، فتتفكك وتعطي الأكسجين.
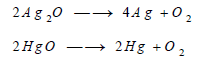
(2) تفكك فوق الأكاسيد
تتفكك بعض فوق الأكاسيد بالحرارة. كما يتفكك بعضها الآخر في وجود الماء أو في وجود الأحماض :
(أ) التفكك بالحرارة
– حصل (شيل) على غاز الأكسجين بتسخين ثاني أكسيد المنجنيز عند درجة حرارة عالية:
يتضح من هذه المعادلة أن ناتج التفاعل هو أيضا أكسيد يشبه أكسيد الحديدوز Fe3O4 ويتفكك فوق أكسيد الرصاص أيضا بالحرارة مكوناً الليثارج Litharge
يمكن استخدام أكسيد الرصاص الأحمر Pb3O4 في هذا التفاعل. وذلك بتسخين الليثارج في الهواء 450 Co لتكوين الأكسيد الأحمر، ثم رفع درجة الحرارة إلى 550Co لتفكيك هذا الأكسيد الأحمر إلى الليثاريج والأكسجين مرة أخري.
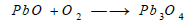
– ويتفكك فوق أكسيد الباريوم أيضا بالحرارة، ويتكون فوق أكسيد الباريوم بتسخين أكسيد الباريوم ثم ينحل بعد ذلك عند بلوغ درجة الحرارة إلى نحو 800 Co
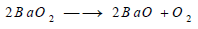
(ب) التفكك في وجود الأحماض
تتفكك بعض فوق الأكاسيد في وجود الأحماض. ومثال ذلك تفكك فوق أكسيد المنجنيز في وجود حامض الكبريتيك طبقا للمعادلة التالية:
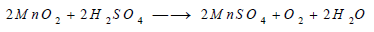
ولا يصلح استخدام حمض الهيدروكلوريك في هذا التفاعل، لأن ناتج التفاعل في هذه الحالة هو غاز الكلور.
(جـ) التفكك في وجود الماء
تتفاعل بعض فوق الأكاسيد مثل فوق أكسيد الصوديوم مع الماء وينطلق منها غاز الأكسجين:
وقد استخدم هذا التفاعل مدة ما في تحديد الهواء في الأماكن المغلقة، فهو يطلق غاز الأكسجين في الهواء، ويمتص منه غاز ثاني أكسيد الكربون الناتج من التنفس بواسطة الأساس الناتج في التفاعل.
(3) تفكك الأملاح
– تتفكك كلورات البوتاسيوم عند تسخينها إلى درجة الانصهار، أي عند 270 Co هي تتحول إلى خليط من كلوريد البوتاسيوم، وفوق كلورات البوتاسيوم، وعند رفع درجة حرارة هذا الخليط إلى 400 Coتفقد فوق الكلورات الأكسجين وتتحول إلى الكلوريد.
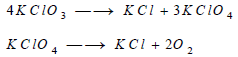
– تتفكك أيضا برمنغنات البوتاسيوم عند تسخينها تسخيناً هينا مكونة برمنغنات البوتاسيوم والأكسجين:
– أما ثاني كرومات البوتاسيوم فلا تنحل وحدها بالحرارة، ولكنها تتفاعل مع حمض الكبريتيك المركز وتطلق الأكسجين:
(4) التحليل الكهربي للماء
– يتحلل الماء كهربائياً بوجود كميات صغيرة من الأملاح أو الحموض أو الأسس. فينطلق الأكسجين على المصعد والهيدروجين على المهبط، وتكون النواتج بدرجة نقاوة عالية:
– يحضر الأكسجين صناعيا باستخدام التحليل الكهربائي للماء ومن الهواء بعد تمييعه.
– أحدى الطرق الشائعة للحصول على الأكسجين من الهواء تتلخص بإمرار للهواء المضغوط لحوالي 10 جو على المرشح للتخلص من الغبار العالق في الهواء ومن ثم يتخلص من غاز ثاني أكسيد الكربون والرطوبة بإمرار الهواء على محلول أساسي ومادة شرهة للماء، ثم يؤخذ الهواء الناتج ويضغط لحوالي 200 جو ويبرد إلى الدرجة العادية، يمدد فجائيا فتنخفض درجة الحرارة ، وتكرر هذه العملية عدة مرات إلى أن يتميع الهواء بالتقطير الجزئي للهواء المميع يعطي النتروجين أولا الذي يكون حاوياً على كمية قليلة من الأرجون والأكسجين عند درجة الحرارة -196 Coومن ثم الأكسجين عند درجة -183 Co ، وهذه الدرجات تمثل درجات الغليان للنتروجين والأكسجين على التوالي.
رابعاً/ الخواص الكيميائية لعنصر الأكسجين Oxygen
– يكون غاز الأكسجين مركبات مع كل العناصر الأخرى فيما عدا الغازات الخاملة. وهو يستخدم لهذا السبب، بالإضافة إلى أسباب أخرى، في حساب الأوزون الذرية لبقية العناصر الأخرى.
– ويمكن تحضير أكاسيد أغلب العناصر بطرق مباشرة، أي بالاتحاد المباشر بين العنصر والأكسجين، فيما عدا الفلزات النبيلة مثل الفضة والذهب والبلاتين، وكذلك الهالوجينات التي تحضر أكاسيدها بطرق غير مباشرة.
تفاعلات الأكسدة
– تعني الأكسدة اتحاد المادة بالأكسجين، على حين يعني الاختزال إزالة الأكسجين من المادة، رغم أنه يعني أيضا إضافة الهيدروجين في حالات أخري.
– تختلف سرعة عملية التأكسد من حالة إلى أخرى ، فهي قد تكون سريعة وتحدث بعنف شديد، ويصدر عنها ضوء وحرارة كما في حالة الاحتراق أو تكون بطيئة كما في حالة صدأ الحديد، أو جفاف الزيوت النباتية المستخدمة في عمليات الطلاء.
– تعرف عملية الأكسدة بصفة عامة على أنها فقد الذرة لإلكترون أو أكثر. وتعني عملية الاختزال اكتساب الذرة المتعادلة لإلكترون أو أكثر.
– يعد غاز الأكسجين غازاً فعالا ونشيطاً ، فهو يتحد بعديد من العناصر والمركبات في درجة حرارة الغرفة. وعند درجات حرارة مرتفعة تشتعل بعض المواد في وجود الأكسجين.
(أ) التأكسد في درجة حرارة الغرفة
– يشتعل الفوسفور أو يتوهج عند تعرضه للهواء في درجة الحرارة العادية، وهو يكون في الهواء الجاف أكسيد الفوسفور.
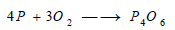
– يتحد أيضا أكسيد النيتريك بالأكسجين في درجة حرارة الغرفة مكونا سحباً بنية اللون من فوق أكسيد النتروجين:
– يتحد غاز الأكسجين بغاز الهيدروجين عند درجات الحرارة العادية في وجود عامل مساعد مناسب مثل فلز النيكل. كما تتأكسد بعض المركبات العضوية عند تعرضها للهواء في درجات الحرارة العادية، مثل الأمينات والفينولات.
– يضاف إلى ذلك أن عملية التنفس في الكائنات الحية تؤدي إلى حدوث عمليات أكسدة في الخلايا الحية في درجات الحرارة المعتادة.
(ب) التأكسد في درجة الحرارة العالية
– يحترق الكبريت في الهواء مكونا ثاني أكسيد الكبريت، وعندما يحترق الكبريت في جو من الأكسجين يتكون قدر صغير من ثالث أكسيد الكبريت
– ويحترق الكربون في الهواء مكون ثاني أكسيد الكربون، ويتكون في هذا التفاعل قدر من أول أكسيد الكربون نتيجة لاختزال بعض ثاني أكسيد الكربون بواسطة عنصر الكربون:
– يحترق السيليكون والبورون في جو من الأكسجين لتكوين الأكاسيد المقابلة لكل منها.
– أما النتروجين فلا يتحد بالأكسجين إلا عند درجة حرارة القوس الكهربائي، ويتكون في هذه الحالة أكسيد النتريك وعند انخفاض درجة الحرارة إلى 800 Co يتكون قدر آخر من فوق أكسيد النتروجين:
– يختلف الأمر بالنسبة للفلزات من حالة إلى أخرى ، فالفلزات الثقيلة مثل الفضة والذهب والبلاتين، لا تتأكسد بسهولة، أما بقية الفلزات الأخرى مثل الصوديوم والبوتاسيوم والمغنزيوم فهي تشتعل في الهواء وهي على هيئة باردة أو مسحوق فقط، ويمكن تمثيل تفاعل الفلزات مع الأكسجين بالمعادلة التالية:
– تحتاج عملية أكسدة النشادر إلى أكسيد النتريك في استخدام عامل مساعد من هذا النوع حتى يسري التفاعل:
خامساً/ استخدامات عنصر الأكسجين Oxygen
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر