الهيدروجين Hydrogen – معلومات هامة عن عنصر الهيدروجين
محتويات الموضوع
تعريف الهيدروجين Hydrogen definition
– الهيدروجين Hydrogen هو أول عناصر الجدول الدوري ولذراته ابسط تركيب الكتروني معروف ( مدار تكافؤي واحد وإلكترون واحد) 1S1
– سمي الهيـدروجين بهذا الاسم نسبة إلى اللغة اللاتينية وتعني مكون الماء.
– يقع فى الدورة الأولى والمجموعة الأولى من الجدول الدوري للعناصر.
– الهيدروجين غاز قليل الكثافة،عديم اللون والطعم والرائحة، لا يساعد على التنفس أو الاحتراق ولكن يشتعل في الهواء بلهب أزرق غير مضئ مكوناً الماء، وهو عديم الذوبان فيه.
تواجد الهيدروجين فى الطبيعة Hydrogen In Nature
– يؤلف الهيدروجين حوالي 0.87% من وزن القشرة الأرضية ، إذ يوجد بصورة متحدة في جميع الأنسجة وكذلك في الماء ومركبات الهيدروجين تفوق بقية مركبات العناصر وبضمنها الكربون.
– للهيـدروجين بسبب خفة جزيئاته المتناهية، سرعة انتقال كافية للانفلات من مجال الجاذبية الأرضية.
– ويفترض من نتائج الدراسات الطيفية أن الهيدروجين يؤلف حوالي 30% من وزن الشمس.
– أحدى النظريات المهتمة بدراسة نشوء الكون يعد الهيـدروجين القاعدة الأساسية في تكوين النجوم .
– ونظراً لكون الهيدروجين أكثر عناصر الكون انتشاراً فمن المحتمل أن العناصر الأخرى تكونت منه تدريجياً بفعل عمليات الانصهار النووي Nuclear Fusion فى النجوم.
اكتشاف الهيدروجين Discovery of Hydrogen
– مع أن الهيدروجين قد تم جمعه من قبل باحثين قدامى الأ أن هنري كافندش يعد أول من صنفه ودرسه بصورة تفصيلية في سنة 1766، إذ لاحظ تحرر نفس الكمية من الهيـدروجين عند تفاعل وزن محدد من فلزات معينة (مثل الخارصين أو الحديد أو القصدير) مع الأحماض المخففة (مثل حمض الكبريتيك أو حمض الهيدروكلوريك) وعزى ذلك إلى الفلز نفسه وعده مصدراً للغاز المنبعث وحينئذ أطلق علية الهواء المشتعل من الفلزات.
– فى السنوات 1781-1784 بين نفس الباحث تكون الماء من تفجير الغاز فى الهواء أو فى الأكسجين.
– أطلق العالم لافوازيه اسم الهيدروجيـن على هذا الغاز والذي يعنى باللاتينيه مكون الماء.
– سنة 1899 توصل العالم ترافرس Travers إلى طريقة إسالته.
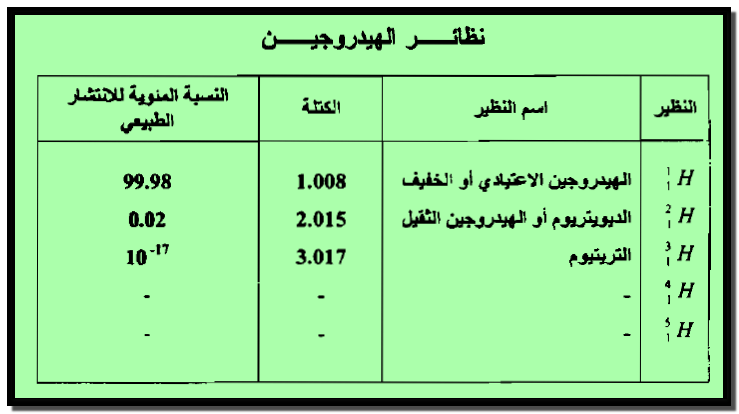
نظائر الهيدروجين Hydrogen Isotopes
– يوجد للهيدروجـين خمسة نظائر وهي موضحة بالجدول التالي وتعد النظائر الثلاثة الأولى بالنسبة للكيميائيين أهم النظائر الخمسة.
– لنظير التريتيوم 1H3 نشاط إشعاعي تبلغ فتره عمر النصف ( (t½12.4 سنة والمعادلة التالية تعبر عن طريقة انحلاله كما يلي:
– بينما النظيرين 1H4 ، 1H5 فإنهما نظائر مصنعة (أي مخلقة) اكتشفت حديثاً , فترة عمر النصف لهما قصيرة جداً والمعادلتان الآتيتان تعبران عن انحلالهما كما يلي:
تحضير الهيدروجين Preparation of Hydrogen
(1) تحضير الهيدروجين فى المختبر
– يمكن الحصول على الهيدروجين بعدة طرق منها مختبرية ومنها صناعية.
– ففي المختبر مثلاً يحضر الهيدروجـين من تفاعل الفلزات النشيطة مثل الخارصين أو الحديد مع الأحماض المخففة أو من تفاعلات الفلزات القلوية مثل الصوديوم أو هيدريدات الفلزات مثل هيدريد الكالسيوم CaH2 مع الماء أو بتحليل كهربائياً كما بالمعادلات الآتية:
Zn + 2H+ → Zn2+ + H2
NaH + H2O → NaOH + H2
CaH2 + H2O → Ca(OH)2 + H2
(2) تحضير الهيدروجين فى الصناعة
يمكن الحصول على الهيدروجيـن صناعياً بالطرق الآتية كما يلي:
2H2O (l) → O2 (g) + 2H2(g)
– وذلك بإمرار تيار كهربي بين قطبين مغموسين فى الماء حيث يشكل الهيـدروجين على المهبط والأكسجين على المصعد، حيث يصنع المهبط عادة من البلاتين أو أى فلز خامل آخر.
– لا يمكن الاعتماد على هذه العمليّة لإنتاج الهيـدروجين صناعيّاً لأنّها غير مجدية اقتصاديّاً، وذلك للطاقة الكبيرة المستهلكة لإجراء العمليّة، ولحدوث تفاعلات جانبيّة تقلّل من الكفاءة.
(2) امرار بخار الماء على فحم الكوك المسخن
C + H2O → CO + H2
ومن ثم يمرر الناتج الذي يسمى بغاز الماء مع بخار الماء على عامل حفاز مكون من أكسيد الحديد وأكسيد الكروم عند درجة حرارة 300 Co
CO + H2 + H2O → CO2 + 2H2
ويمكن التخلص من غاز ثاني أكسيد الكربون وأول أكسيد الكربون بإمرار الغازات المتحررة في الماء تحت ضغط 50 جو أولاً ومن ثم خلال كلوريد النحاسوز الأمونيا.
(3) إمرار غاز الميثان CH4 على عامل حفاز مكون من طبقة من النيكل المنشط والمسخن إلى درجة 750 Co
مع أن هذه العملية معقدة جداً إلا انه يمكن التعبير عنها بالتفاعل الأساسي التالي كما يلي:
CH4 + H2O ↔ CO + 3H2
ويعقب هذا تفاعل آخر يجري على سطح العامل الحفاز المكون من الحديد والنحاس كما يلي:
CO + H2O ↔ CO2 + H2
ويُزال غاز ثاني أكسيد الكربون من مزيج التفاعل بإمراره في محلول كربونات البوتاسيوم ، وأما الكميات الضئيلة المتبقية (والتي تعتبر كسموم) فإنها تتحول بتأثر العوامل الحفازة إلى غاز الميثان.
CO + 3H2 ↔ CH4 + H2O
CO2 + 4H2 ↔ CH4 + 2H2O
الخواص الفيزيائية للهيدروجين Physical properties of hydrogen
– للهيدروجين صفات فيزيائية وكيميائية استثنائية وفريدة في حد ذاتها ويعزي ذلك إلى الترتيب الإلكتروني لحالته المستقرة أولاً وكونه أخف العناصر المعروفة
– وحسب مفهوم لويس يمكن الحصول من تركيب الحالة المستقرة (1S1) على ترتيبات الكترونية مستقرة أخرى أما عن طريق المشاركة أو اكتساب إلكترون أخر.
– وبالإضافة إلى ذلك فإن البروتون H+ المشتق من إزالة إلكترون ذرة الهيدروجين التكافؤي هو مثال آخر للعينات المدروسة جيداً.
– أن أبسط الاعتبارات التكافؤية تدل على إمكانية ذرة الهيدروجين على تكون مركبات تحتوي على رابطة تساهمية أحادية ومركبات أخري تحتوي على الهيدروجين بصورته الأيونية ومن هنا يتعامل الهيدروجين بصورة مستقلة وفضل تصنيفه في مكان مستقل في الجدول الدوري.
(1) مميزات الهيدروجين
- غاز قليل الكثافة
- عديم اللون والطعم والرائحة
- لا يساعد على التنفس أو الاحتراق ولكن يشتعل في الهواء بلهب أزرق غير مضئ مكوناً الماء
- وهو عديم الذوبان فيه.
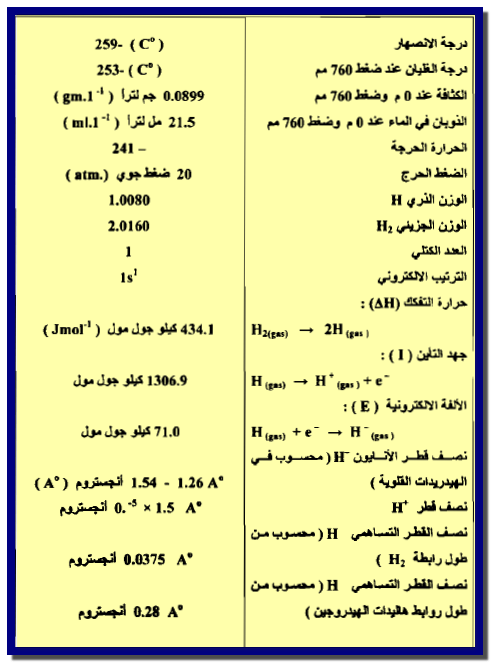
وأهم صفاته مبينة فى الجدول التالي كما يلي:
(2) يظهر الهيدروجين تشابها ً ملحوظاً مع عناصر ثلاث مجموعات فى الجدول الدوري
(أ) الهالوجينات:
يشبه الهيدروجين الهالوجينات من حيث قابليته على اكتساب إلكترون واحد مكوناً أيون الهيدريد H–
(ب) الفلزات القلوية:
يشبه الهيدروجين الفلزات القلوية إذ بإمكانه وتحت ظروف خاصة فقدان إلكترونه الوحيد مكوناً البروتون H+
(جـ) مجموعة الكربون:
– يشبه الهيدروجين إلى درجة ما عناصر مجموعة الكربون إذ أنه يملك غلاف تكافؤي نصف مملوء يسهل علية تكوين روابط تساهمية ذات مدى واسع من القطبية.
– وهذه الصفة تنطبق فقط في حالة مقارنته مع الكربون الحاوي على غلاف تكافؤي واحد وحر (غير مشغول) كما في H3C-
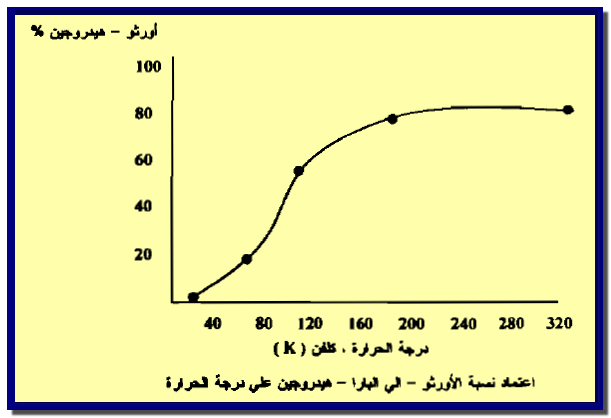
(3) الأورثو – بارا هيدروجين Ortho and Para hydrogen
– لجزئية الهيدروجين صفة فيزيائية أخرى جديرة بالاهتمام هي الأورثو- والبارا هيدروجين.
– وكما هو الحال في جميع الجزئيات الثنائية الذرة والتي تمتلك نواياتها صفة البرم نجد أن جزئية الهيدروجين تظهر ما يسمى بأيزومرزم البرم Spin Isomerism.
– وهذا ناتج من احتمالية ظهور برم النواتين بصورتين مختلفتين معتمداً على الاتجاه. فعندما يكون البرم النووي للنواتين بنفس الاتجاه (متوازيين). وعلى سبيل المثال أما كلاهما باتجاة عقرب الساعة أو عكسه يطلق علية بالأيزومر أورثو Ortho-hydrogen وفي حالة كون برم النواتين باتجاهين متعاكسين كان يكون أحدهما باتجاه عقرب الساعة والآخر عكسه يعرف بالأيزومر بارا Para-hydrogen .
– غاز الهيدروجين عبارة عن مزيج متزن من الأورثو- والبارا هيدروجين كما فى الشكل التالي كما يلي:
– يتبين من الشكل يكون الأيزومر بارا- هيدروجين أكثر استقراراً في درجات الحرارة المنخفضة إذ تبلغ نسبته حوالي 100% عند الصفر المطلق.
– وبارتفاع درجة الحرارة تزداد نسبة اتزان الأورثو- هيدروجين حتى تصل إلى حوالي 75%عند درجة حرارة الغرفة.
– كما أن التحول من إيزومر إلى آخر بطئ ولكن يمكن تحفيزه باستعمال العديد من المواد المحفزة مثل الهيدروجين الذري أو المواد البارامغناطيسية مثل O2 ، NO ومركبات العناصر الانتقالية وتزداد نسبة التحول بازدياد صفة البارامغناطيسية للعامل الحفاز.
الخواص الكيميائية للهيدروجين Chemical properties of Hydrogen
– بالرغم من عدم فعالية الهيدروجين إلا أنه يحترق في الهواء مكوناً الماء.
– ويتفاعل مع معظم اللافلزات في ظروف متباينة كما هي موضحة في التفاعلات الآتية كما يلي:
(1) الأحتراق
– يحترق الهيدروجين في جو من الأكسجين كما بالمعادلة الآتية:
2H2 + O2 → 2H2O
(2) التفاعل مع الهالوجينات
– إن التفاعل مع الفلور يكون مصحوباً بانفجار، وأما في حالة الكلور فيكون مصحوباً باشتعال، أما في حالتي البروم واليود فأن التفاعل عكسي. وتكون الصيغة العامة للتفاعل كما يلي:
H2 + X2 → 2HX [ X = F,Cl,Br,I ]
(3) التفاعل مع الكبريت
– يحترق الكبريت في جو من الهيدروجين كما بالمعادلة الآتية:
H2 + S → H2S
(4) التفاعل مع النيتروجين
– يحدث هذا التفاعل عند درجة حرارة 500 Co ، 200 ضغط جوي وفي وجود الحديد عاملاً حفازاً كما بالمعادلة الآتية:
3H2 + N2 → 2NH3
(5) التفاعل مع الفلزات الكهروموجبة
– يتحد الهيدروجين مع الفلزات الكهروموجبة وتحت ظروف معينة مكوناً هيدريدات.
– فمثلاً يحضر هيدريد الصوديوم صناعياً من تمرير غازالهيدروجين النقي على مصهور معدن الصوديوم عند درجات حرارة بين 250 – 300 Co
H2 + Na → NaH½
(6) القدرة على الاختزال
– إذ يختزل العديد من الأكاسيد بدرجات الحرارة العالية محولاً إياها أما إلى أكاسيدها الأقل (بالنسبة إلى تكافؤ الفلز) أو إلى الفلز نفسه.
– وبوجود عوامل حفازة مثل البلاتين أو أكسيد البلاتين يكون الهيدروجين قادراً على اختزال الكثير من المركبات العضوية (في محاليل مذيبات عضوية معينة مثل الكحول أو حامض الخليك).
– فمثلاً يختزل المركبات غير المشبعة ، عن طريق الإضافة، فيحولها إلى مركبات مشبعة.
– بالإضافة إلى ذلك فأنه له القدرة على اختزال الألدهيدات إلى كحولات أولية ومركبات نيتروجينة محدودة إلى الأمونيا أو الأمينات كما فى المعادلات الآتية:
CnH2n + H2 → CnH2n+2
RCHO + H2 → RCH2OH
N2O + 3H2 → N2H4 + H2O
(7) تفكك الهيدروجين Dissociation of hydrogen
– تتطلب عملية تفكك الهيدروجين H2 إلى حرارة عالية جداً (تقريباً 2000 Co). وهذا يعتبر تفسيراً جزئياً لعدم فعاليته في درجات الحرارة العادية كما بالمعادلة الآتية:
H2 → 2H ΔH= 434.1 KJmol-1
– وفي الحالة الغازية وتحت ضغط معين فإن إعادة تكون الهيـدروجين الجزيئي (كما في المعادلة السابقة) عملية بطيئة نسبياً فمثلاً لذرات الهيدروجين تحت ضغط 0.2 م.زئبق عمر نصف زمني قدرة ثانية واحدة.
– ولكن في حالة وجود غاز غير فعال وتحت ضغط عالي أو في وجود فلزات معينة مثل البلاتين أو البلاديوم أو التنجستن يكون مثل هذا الاتحاد (إعادة تكوين الهيـدروجين الجزيئي) سريعاً جداً نظراً لأن الحرارة المتحررة من تكوين جزيئة H2 يمكن إزالتها من وسط التفاعل.
– تتم عملية تفكيك الهيـدروجين في أنابين التفريغ ذات الضغط المنخفض وبفعل الأقواس الكهربائية أو قصفه بإلكترونات ذات مدى طاقي 10-20 إلكترون فولت أو بالأشعة فوق البنفسجية.
– ويمكن تحرير الهيـدروجين الذري فى المحلول أيضاً أما بتعريض مذيبات معينة حاوية على الهيدروجين إلى إشعاع مؤين أو بتحليل النايولات ضوئياً كما بالمعادلة الآتية:
RSH → RS. + H.
(8) الروابط الهيدروجينية
نظراً لأن موضوع الروابط الهيدروجينية لا يمكن تناوله باختصار فقد تم كتابة موضوع بالكامل عن الروابط الهيدروجينية. ويمكن قرأته من هنا : الروابط الهيدروجينية
استخدامات غاز الهيدروجين Uses of Hydrogen gas
حتى هذا القرن كان استعمال الهيدروجين بكميات قليلة فقط وذلك كوقود بشكل غاز الاستصباح وغاز الماء. ومن أجل إملاء البالونات وفي مواقد اللحام، ولكن تستخدم الآن كميات كبيرة من الهيدروجين في الأغراض الآتية كما يلي:
(1) صناعة النشادر بطريقة هابر، والتي تستخدم بدورها في صناعة حمض الآزوت الذي بدوره يستخدم في تحضير المتفجرات والأصبغة.
(2) صناعة كلوريد الهيدروجين وحمض الهيدروكلوريك.
(3) صناعة بعض المواد العضوية.
(4) صناعة المواد الدسمة كالسمن.
(5) استعمال بعض المعادن من أكاسيدها كالتنكستين والموليبدن.
(6) استخدام الهيدروجين السائل كوقود للصواريخ.
(7) في مجال التطوير: استعمال الهيدروجين لتوليد الكهرباء في السيارات.
المراجع – أسس الكيمياء غير العضوية .محمد مجدي واصل ، الطبعة لأولى / دار الفجر للنشر والتوزيع – القاهرة – جمهورية مصر العربية


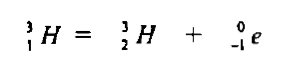
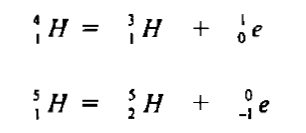



شكرا على هذا المقال الرائع عن الهيدروجين وخصائصه واستخداماته.