الكيمياءالكيمياء العامة
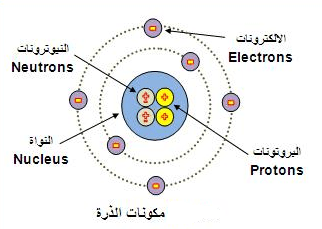
مكونات الذرة ( البروتون Proton – النيترون Neutron – الإلكترون Electron )

(1) الذرة Atom
** هي عبارة عن جسيم متناهي في الصغر
يحتوي على نواة وتكون معظم كتلة الذرة (massive
nucleus).
** هذه النواة تحتوي على بروتونات
موجبة الشحنة (P+) ونيترونات متعادلة الشحنة (no) ومن ثم فإن النواة موجبة الشحنة تتعادل مع إلكترونات (e–) سالبة
الشحنة التي تدور حول النواة بحيث إن الذرة متعادلة كهربائياً وشحنتها الإجمالية
صفر.
يحتوي على نواة وتكون معظم كتلة الذرة (massive
nucleus).
** هذه النواة تحتوي على بروتونات
موجبة الشحنة (P+) ونيترونات متعادلة الشحنة (no) ومن ثم فإن النواة موجبة الشحنة تتعادل مع إلكترونات (e–) سالبة
الشحنة التي تدور حول النواة بحيث إن الذرة متعادلة كهربائياً وشحنتها الإجمالية
صفر.
** هذا التعريف يجمع تصور كل من
رذرفورد (Rutherford) وبوهر (Bohr) وعلى أساسه وضع كل منهما نموذجاً للذرة.
** نسمى مكونات
أي كل من البروتونات والنيترونات والإلكترونات بالجسيمات دون الذرية Subatomic
particles
رذرفورد (Rutherford) وبوهر (Bohr) وعلى أساسه وضع كل منهما نموذجاً للذرة.
** نسمى مكونات
أي كل من البروتونات والنيترونات والإلكترونات بالجسيمات دون الذرية Subatomic
particles
(2) الإلكترون (e–) Electron
تأكد وجود الإلكترون في الذرة بناء
على شواهد معملية Experimental evidences من خلال تجارب أجراها بلوكر (Plucker) عام 1885 على أشعة المهبط (Cathode
rays) وتحقق أن لها الخصائص التالية:
على شواهد معملية Experimental evidences من خلال تجارب أجراها بلوكر (Plucker) عام 1885 على أشعة المهبط (Cathode
rays) وتحقق أن لها الخصائص التالية:
(1) تتحرك في خط مستقيم بعيداً عن
المهبط Cathode
المهبط Cathode
(2) يمكن لهذه الأشعة أن تنحرف أو تنثني عن مسارها بتأثير مجال كهربائي أو مغناطيسي
باتجاه يدل على أن الجسيمات تحمل شحنة كهربائية سالبة.
باتجاه يدل على أن الجسيمات تحمل شحنة كهربائية سالبة.
(3) قاس العالم Mellikan مابين 1909 -1913
شحنة الإلكترون (e–) بتجربته الخاصة بارتفاع وهبوط قطرات من الزيت مشحونة في وجود
وغياب مجال كهربائي فوجد القيمة (e
= 1.6022 × 10-19 C)
وحدد لها قيمة نسبية .(-1)
شحنة الإلكترون (e–) بتجربته الخاصة بارتفاع وهبوط قطرات من الزيت مشحونة في وجود
وغياب مجال كهربائي فوجد القيمة (e
= 1.6022 × 10-19 C)
وحدد لها قيمة نسبية .(-1)
(4) يحدد كتلة الإلكترون من العلاقة
بين شحنة ووزنه التي حددها طومسون Thomson
عام 1897
بين شحنة ووزنه التي حددها طومسون Thomson
عام 1897
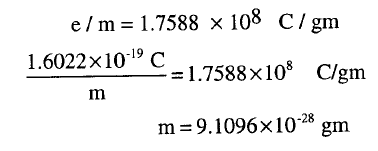
وهو يساوي تقريباً (1/1837) من كتلة ذرة الهيدروجين.
(3) البروتون (P+) Proton
** لاحظ جولدستين عام 1886 ظهور آثار ضوئية على السطح الداخلي لأنبوبة الكاثود خلف كاثود مثقوب. وهذا
يدل على وجود أشعة موجبة تتحرك في الأنبوبة وجزء منها اخترق ثقوب الكاثود وظهر في
نهايتها.
** اعتماداً على الغاز المستخدم لتوهج الأنبوبة قبل تفريغها تمكن من الحصول
على أصغر من هذه الشحنات الموجبة عندما استخدم الهيدروجين في عملية التوهج.
يدل على وجود أشعة موجبة تتحرك في الأنبوبة وجزء منها اخترق ثقوب الكاثود وظهر في
نهايتها.
** اعتماداً على الغاز المستخدم لتوهج الأنبوبة قبل تفريغها تمكن من الحصول
على أصغر من هذه الشحنات الموجبة عندما استخدم الهيدروجين في عملية التوهج.
** هذا الجسيم له نسبة e/m تساوي 9.579 ×
104 واتضح أن
الشحنة المطلقة على هذا الجسيم هي نفس شحنة الإلكترون 1.6022
× 10-19 وحيث أنها موجبة فحدد لها
القيمة النسبية (+1)
104 واتضح أن
الشحنة المطلقة على هذا الجسيم هي نفس شحنة الإلكترون 1.6022
× 10-19 وحيث أنها موجبة فحدد لها
القيمة النسبية (+1)
(4) النيترون (no) Neutron
لاحظ
رذرفورد أن قرابة نصف الكتلة الذرية فقط يمكن تعديلها بالبروتونات وجه هذا التناقض
أنظار الباحثين للبحث عن حل لهذه المشكلة لا يخل بالتوازن الحاصل في الذرة من
ناحية الشحنة حتى اكتشف العالم شادويك Chadwick عام 1932 وجود جسيم ليس له شحنة وكتلته تساوي كتله البروتون ويوجد داخل
النواة وأطلق عليه اسم النيترون ويرمز له بالرمز (no)
رذرفورد أن قرابة نصف الكتلة الذرية فقط يمكن تعديلها بالبروتونات وجه هذا التناقض
أنظار الباحثين للبحث عن حل لهذه المشكلة لا يخل بالتوازن الحاصل في الذرة من
ناحية الشحنة حتى اكتشف العالم شادويك Chadwick عام 1932 وجود جسيم ليس له شحنة وكتلته تساوي كتله البروتون ويوجد داخل
النواة وأطلق عليه اسم النيترون ويرمز له بالرمز (no)
(5) أهم دوال الذرة
العدد الذري
** هو عبارة عن عدد البروتونات الموجودة في نوية ذرة
العنصر.ولما كانت ذرات العناصر المختلفة متعادلة كهربياً فهذا يعني أن عدد
البروتونات = عدد الإلكترونات. لذلك يمكن القول أن:
العنصر.ولما كانت ذرات العناصر المختلفة متعادلة كهربياً فهذا يعني أن عدد
البروتونات = عدد الإلكترونات. لذلك يمكن القول أن:
العدد الذري (Z) = عدد البروتونات (P+) = عدد الإلكترونات (e–)
** يعتبر العدد الذري من مميزات ذرات العنصر الواحد حيث لجميع
ذرات العنصر الواحد نفس العدد الذري وهو يختلف عن العدد الذر لذرات العناصر
الأخرى.
ذرات العنصر الواحد نفس العدد الذري وهو يختلف عن العدد الذر لذرات العناصر
الأخرى.
** العالم الانجليزي هنري موزلى هو أول من عين الأعداد الذرية
لعدد من العناصر باستخدام أشعة اكس (X-rays)
لعدد من العناصر باستخدام أشعة اكس (X-rays)
العدد الكتلي
** هو مجموع أعداد البروتونات وأعداد النيترونات في نوية ذرة
عنصر ما
عنصر ما
العدد الكتلي (A)
= عدد البروتونات (P+)
+ عدد النيترونات (no)
= عدد البروتونات (P+)
+ عدد النيترونات (no)
** لقد اتفق أن يكتب العدد الكتلي إلى يسار الرمز الكيميائي
للعنصر وفي الزاوية العليا العدد الذري فيكتب إلى يسار الرمز الكيميائي وفى
الزاوية السفلى للرمز:
للعنصر وفي الزاوية العليا العدد الذري فيكتب إلى يسار الرمز الكيميائي وفى
الزاوية السفلى للرمز:



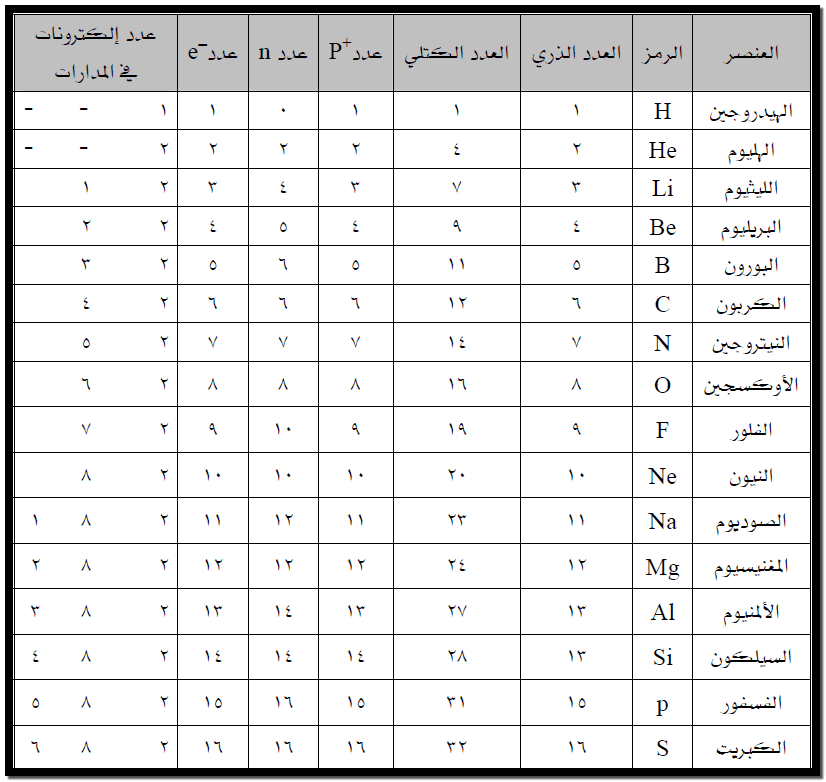
الجدول التالي يحتوي على القيم العددية لبعض المفاهيم ذات العلاقة بالتركيب الذري :
المراجع
– إنتاج كيميائي –
الكيمياء العامة – 180 كيم، الإدارة العامة لتصميم وتطوير المناهج- المملكة العربية
السعودية.
الكيمياء العامة – 180 كيم، الإدارة العامة لتصميم وتطوير المناهج- المملكة العربية
السعودية.
– مبادئ الكيمياء العامة (نظري – مسائل محلولة). محي
الدين البكوش – نوري بسيبسو – ياسر حورية- نبيل شيخ قروش، الطبعة الثانية (2003م) /
شركة الجا للنشر العلمي – طرابلس.
الدين البكوش – نوري بسيبسو – ياسر حورية- نبيل شيخ قروش، الطبعة الثانية (2003م) /
شركة الجا للنشر العلمي – طرابلس.