الكيمياءالكيمياء العامةعناصر الجدول الدورى
عنصر البيريليوم Beryllium

أولاً: ما هو عنصر
البيريليوم؟
** البيريليوم Be عنصر من عناصر الجدول الدوري العدد الذري= 4
، العدد الكتلي= 9
، العدد الكتلي= 9
** التوزيع الإلكتروني لعنصر البيريليوم: 1S2
, 2S2
, 2S2
** البيريليوم عنصر كيميائي ينتمي إلى
عائلة المعادن الأساسية الترابية المكونة للمجموعة 2
في الجدول الدوري للعناصر
عائلة المعادن الأساسية الترابية المكونة للمجموعة 2
في الجدول الدوري للعناصر
** البيريليوم لونه رمادي وهو معدن صلب
وخفيف لكنه هش.
وخفيف لكنه هش.

** يظهر البيريليوم بشكل طبيعي كمكون
لبعض الصخور والتربة وفلزات الكربون وكرماد بركاني.
لبعض الصخور والتربة وفلزات الكربون وكرماد بركاني.
** ونظراً لكون البيريليوم عنصراً فهو
لا يتفكك ولا يمكن إتلافه.
لا يتفكك ولا يمكن إتلافه.
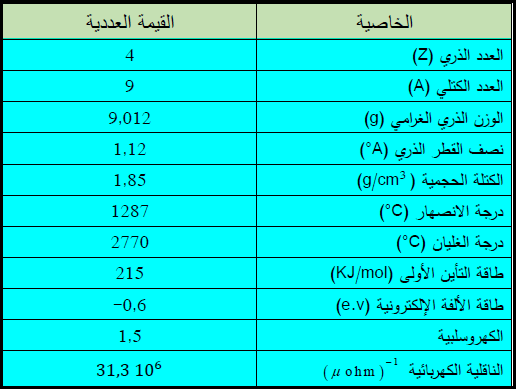
** يوضح الجدول التالي بعض الخزاص العامة لعنصر البيريليوم:
ثانياً: اكتشافه ووجوده في الطبيعة
** اكتشف البيريليوم من قبل العالم
“فاوكولين “Vauquelin
عام 1795م في فرنسا عند
تحليله للبيريل، ولكن أول من عزله هو Wohler
عام 1828م من تأثير البوتاسيوم على كلوريد البيريليوم.
“فاوكولين “Vauquelin
عام 1795م في فرنسا عند
تحليله للبيريل، ولكن أول من عزله هو Wohler
عام 1828م من تأثير البوتاسيوم على كلوريد البيريليوم.
** أصل اسم
البريليوم من اليونانية Beryllos بمعنى أخضر، نسبة
إلى لون الزمرد، الحجر الكريم الأخضر الناتج عن تحول Beryl.
البريليوم من اليونانية Beryllos بمعنى أخضر، نسبة
إلى لون الزمرد، الحجر الكريم الأخضر الناتج عن تحول Beryl.
** يتراوح تركيز البيريليوم في القشرة
الأرضية بين 1 و 5
ملغ/كلغ. ويقدر متوسط تركيز الموجود بشكل طبيعي في التربة ب 250
مرة أكبر من تركيز في مياه تجاويف التربة، وتكون نسبة تركيزه أكبر
بكثير في التربة الطفالية والصلصال.
الأرضية بين 1 و 5
ملغ/كلغ. ويقدر متوسط تركيز الموجود بشكل طبيعي في التربة ب 250
مرة أكبر من تركيز في مياه تجاويف التربة، وتكون نسبة تركيزه أكبر
بكثير في التربة الطفالية والصلصال.
** تتراوح سويات البيريليوم في مياه الشرب
بين 0.01 و 0.7
جزء من المليون. وتكون تراكيزه في الهواء عادة أقل من 0.0005
ميكروجرام/م3.
بين 0.01 و 0.7
جزء من المليون. وتكون تراكيزه في الهواء عادة أقل من 0.0005
ميكروجرام/م3.
** يوجد البريليوم في الأغذية بتركيز
وسطي قدره 22.5 ميكروجرام/كلغ مقيسا في 38
مادة غذائية مختلفة.
وسطي قدره 22.5 ميكروجرام/كلغ مقيسا في 38
مادة غذائية مختلفة.
** يكون شكل البيريليوم المنطلق في الهواء
عادة على هيئة أكسيد البريليوم، الذي يسقط على الأرض في نهاية المطاف إما مع الأمطار
والثلوج أو على هيئة جسيمات صلبة.
عادة على هيئة أكسيد البريليوم، الذي يسقط على الأرض في نهاية المطاف إما مع الأمطار
والثلوج أو على هيئة جسيمات صلبة.
** لا ينحل أكسيد البيريليوم بسهولة ولا
يتحرك بسرعة في التربة أو الماء، ولا يبدو أنه يتراكم في النباتات والحيوان.
يتحرك بسرعة في التربة أو الماء، ولا يبدو أنه يتراكم في النباتات والحيوان.
** تكون نسبة تركيز البيريليوم في النباتات
إلى نسبته في التربة ضعيفة عادة، وتقدّر ب 0.15
%.
إلى نسبته في التربة ضعيفة عادة، وتقدّر ب 0.15
%.
** رغم قدرة التفاعلات الكيميائية على
تحويل البيريليوم من مركب لآخر، فإن البيريليوم بحد ذاته لا يمكنه أن يتفكك بواسطة
التفاعلات البيئية.
تحويل البيريليوم من مركب لآخر، فإن البيريليوم بحد ذاته لا يمكنه أن يتفكك بواسطة
التفاعلات البيئية.
** أهم خامات البيريليوم:
البيريل (Beryl):
3BeO, Al2O3 , 6SiO2
3BeO, Al2O3 , 6SiO2
الهلفين (Helvine):
(Mn, Fe, Zn)6 (Be6Si6O24S2)
(Mn, Fe, Zn)6 (Be6Si6O24S2)
ثالثاً: طرق تحضير البريليوم
(أ) يستحصل البيريليوم من البيريل بطريقة
الصهر والإطفاء حيث:
الصهر والإطفاء حيث:
** يصهر البيريل في فرن كهربائي عند
الدرجة 1650 – 1600 °م ويطفأ على شكل زجاجي بصبه في الماء
الدرجة 1650 – 1600 °م ويطفأ على شكل زجاجي بصبه في الماء
** ثم يعالج بحمض الكبريت فينحل على شكل
كبريتات ويبقى السيليس.
كبريتات ويبقى السيليس.
** ثم تضاف كبريتات الأمونيوم فيترسب
الشب NH4Al(SO4)12H2O
القليل الذوبان ويبقى BeSO4
في المحلول في المحلول
الشب NH4Al(SO4)12H2O
القليل الذوبان ويبقى BeSO4
في المحلول في المحلول
** فيضاف الأساس فيتحول إلى Be(OH)2
ثم تكلس فتعطي الأكسيد الذي يتفاعل مع HCl
ليعطي BeCl2
الذي يحلل كهربائيا، وبذلك نتحصل على البيريليوم.
ثم تكلس فتعطي الأكسيد الذي يتفاعل مع HCl
ليعطي BeCl2
الذي يحلل كهربائيا، وبذلك نتحصل على البيريليوم.
(ب) يحضر البيريليوم أيضا من اختزال فلوريد
بمعدن الماغنسيوم بالتسخين:
بمعدن الماغنسيوم بالتسخين:
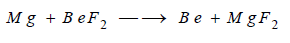
رابعاً: الخواص الكيميائية لعنصر البريليوم
(1) تفاعل البريليوم مع الماء
لا يتفاعل البيريليوم مع الماء حتى في
درجة انصهار الاحمرار، ويعود هذا الخمول إلى تشكل طبقة كتومة رقيقة من الأكسيد التي
لا تنحل حتى في الماء الساخن.
درجة انصهار الاحمرار، ويعود هذا الخمول إلى تشكل طبقة كتومة رقيقة من الأكسيد التي
لا تنحل حتى في الماء الساخن.
(2) التفاعل مع العناصر الأخرى
(أ)
تفاعل البريليوم مع النيتروجين
تفاعل البريليوم مع النيتروجين
يتفاعل البيريليوم مع الآزوت بالتسخين
إلى درجات مناسبة ولتشكيل مركب يدعى النتريد وهذا المركب يتحلل بسرعة في الماء (Hydrolysis)
ويتشكل هيدروكسيد البيريليوم وينطلق غاز النشادر.
إلى درجات مناسبة ولتشكيل مركب يدعى النتريد وهذا المركب يتحلل بسرعة في الماء (Hydrolysis)
ويتشكل هيدروكسيد البيريليوم وينطلق غاز النشادر.
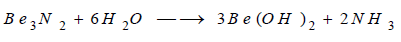
(ب)
تفاعل البريليوم مع الكربون
تفاعل البريليوم مع الكربون
يتفاعل البيريليوم بالتسخين مع الكربون
ويتشكل الميثانيد ذو الصيغة Be2C
الذي يتحلل بسرعة في الماء ويطلق غاز الميثان
ويتشكل الميثانيد ذو الصيغة Be2C
الذي يتحلل بسرعة في الماء ويطلق غاز الميثان
(جـ)
تفاعل البريليوم مع الفوسفور
تفاعل البريليوم مع الفوسفور
يتفاعل البيريليوم مع الفوسفور بالحرارة
ويتشكل فوسفيد البيريليوم Be3P2
الذي يتحلل بسرعة في الماء ويتشكل هيدروكسيد البيريليوم وينطلق غاز
الفوسفين:
ويتشكل فوسفيد البيريليوم Be3P2
الذي يتحلل بسرعة في الماء ويتشكل هيدروكسيد البيريليوم وينطلق غاز
الفوسفين:
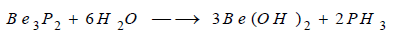
(د)
تفاعل البريليوم مع الهالوجينات والكبريت
تفاعل البريليوم مع الهالوجينات والكبريت
يتفاعل البيريليوم مع الهالوجينات ويشكل
هاليد البيريليوم، كذل يتفاعل مع الكبريت ويتشكل كبريتيد البريليوم BeS
الذي يتحلل بالماء ويطلق غاز كبريتيد الهيدروجين.
هاليد البيريليوم، كذل يتفاعل مع الكبريت ويتشكل كبريتيد البريليوم BeS
الذي يتحلل بالماء ويطلق غاز كبريتيد الهيدروجين.
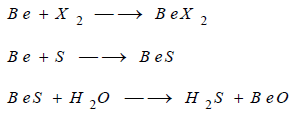
(3) تفاعل البريليوم مع الأحماض
يتفاعل البيريليوم مع الأحماض مثل HCl،
H2SO4
وينطلق غاز الهيدروجين
H2SO4
وينطلق غاز الهيدروجين
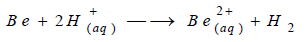
إلاّ أنّه لا يتفاعل مع حمض النيتريك
HNO3
نظراً لتشكل طبقة الأكسيد العازلة.
HNO3
نظراً لتشكل طبقة الأكسيد العازلة.
(4) تفاعل البريليوم مع القواعد
** يتفاعل البيريليوم مع القواعد ويشكل
شاردة البيريلات السالبة وينطلق غاز الهيدروجين وهو يعتبر من العناصر التي لها صفات
مترددة (أمفوترية):
شاردة البيريلات السالبة وينطلق غاز الهيدروجين وهو يعتبر من العناصر التي لها صفات
مترددة (أمفوترية):
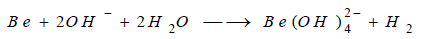
** كما ينحل في المحلول المائي لثنائي
فلوريد الأمونيوم:
فلوريد الأمونيوم:
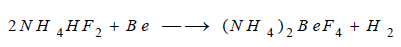
خامساً: استخدامات عنصر البريليوم
(1) يستعمل البيريليوم لقساوته في الخلائط
المعدنية وخاصة مع النحاس وكذلك مع الألمنيوم والنيكل والكوبالت وجميعها مقاومة للتآكل.
المعدنية وخاصة مع النحاس وكذلك مع الألمنيوم والنيكل والكوبالت وجميعها مقاومة للتآكل.
(2) يستخدم البريليوم في صنع نوافذ أنابيب
الأشعة السينية وفي المفاعلات النووية من حيث هو مصدر للنترونات.
الأشعة السينية وفي المفاعلات النووية من حيث هو مصدر للنترونات.
(3) يستخدم معدن البيريليوم النقي في
الصواريخ والقذائف ومكونات الصواريخ والطائرات وفي الأسلحة النووية.
الصواريخ والقذائف ومكونات الصواريخ والطائرات وفي الأسلحة النووية.
(4) تستخدم رقائق البيريليوم مع كشوف
التشخيص التي تستخدم الأشعة السينية، فتمنع مرور الضوء المرئي وتسمح فقط بمرور أشعة
X وذلك بنفاذية
عالية تبلغ سبع عشر ضعف الألمنيوم الذي كان يستخدم سابقا لهذا الغرض.
التشخيص التي تستخدم الأشعة السينية، فتمنع مرور الضوء المرئي وتسمح فقط بمرور أشعة
X وذلك بنفاذية
عالية تبلغ سبع عشر ضعف الألمنيوم الذي كان يستخدم سابقا لهذا الغرض.
(5) يستخدم البريليوم في الجيروسكوبات
أي الأجهزة الداخلة في أنظمة توجيه وحفظ توازن الصواريخ وسفن الفضاء والأقمار الصناعية.
أي الأجهزة الداخلة في أنظمة توجيه وحفظ توازن الصواريخ وسفن الفضاء والأقمار الصناعية.
(6) يدخل في صناعة أجهزة الحاسوب وملحقاتها،
نوابض الساعات والأدوات الأخرى التي يعتبر فيها خفة الوزن والصلابة وثبات الأبعاد صفات
مهمة ومرغوبة.
نوابض الساعات والأدوات الأخرى التي يعتبر فيها خفة الوزن والصلابة وثبات الأبعاد صفات
مهمة ومرغوبة.
(7) يستخدم أكسيد البيريليوم في العديد
من التطبيقات التي تحتاج إلى نقل حراري ممتاز، وصلابة وقوة عاليتين، ودرجات انصهار
عالية تستخدم كعوازل كهربائية.
من التطبيقات التي تحتاج إلى نقل حراري ممتاز، وصلابة وقوة عاليتين، ودرجات انصهار
عالية تستخدم كعوازل كهربائية.
سادساً: تأثير البريليوم على جسم الإنسان
** يتعلق المصير الذاتي للبيريليوم بالشكل
الذي يدخل فيه إلى الجسم، لا تنحل غالبية مركباته بسهولة ولا تمتص بيسر من قبل الطرق
المعوية المعدية.
الذي يدخل فيه إلى الجسم، لا تنحل غالبية مركباته بسهولة ولا تمتص بيسر من قبل الطرق
المعوية المعدية.
** يطرح البيريليوم الذي تم امتصاصه بشكل
بطيء جدا وينحو إلى التراكم في الهيكل العظمي. ويمكن لجسيمات غبار البيريليوم أن تدخل
عن طريق التنفس وتترسب في الرئتين. غير أنه يمكن لبعض الجسيمات المترسبة هذه أن تخرج
من الرئتين.
بطيء جدا وينحو إلى التراكم في الهيكل العظمي. ويمكن لجسيمات غبار البيريليوم أن تدخل
عن طريق التنفس وتترسب في الرئتين. غير أنه يمكن لبعض الجسيمات المترسبة هذه أن تخرج
من الرئتين.
** ورغم عدم إمكانية استقلاب البيريليوم
في الجسم إلا أن أشكاله المنحلة قد تتحول إلى مركبات أقل انحلالية في الرئتين.
في الجسم إلا أن أشكاله المنحلة قد تتحول إلى مركبات أقل انحلالية في الرئتين.
** ينتقل البيريليوم الممتص في الدم إلى
نسيج واعطاء الجسم، ويتراوح عمر النصف لمركبات البيريليوم المستنشقة الحلولة بين 2
و 8 أسابيع.
نسيج واعطاء الجسم، ويتراوح عمر النصف لمركبات البيريليوم المستنشقة الحلولة بين 2
و 8 أسابيع.
** يمكن أن يؤدي استنشاق البيريليوم إلى نمطين من
الأمراض التنفسية:
الأمراض التنفسية:
(أ) مرض بيريليوم حاد: يحصل المرض الحاد
عادة بعد التعرض لسويات عالية من أشكال البيريليوم الأكثر انحلالا وتتراوح مظاهره من
التهاب الممرات الأنفية وحتى ذات الرئة الكيميائي العنيف.
عادة بعد التعرض لسويات عالية من أشكال البيريليوم الأكثر انحلالا وتتراوح مظاهره من
التهاب الممرات الأنفية وحتى ذات الرئة الكيميائي العنيف.
(ب) مرض بيريليوم مزمن: يحصل مرض البيريليوم
المزمن من استنشاق سويات ضعيفة من البيريليوم وهومن نمط الاستجابة التحسسية. يتميز
المرض بتشكل عقد أو تحبب في الرئتين. يمكن أن تكون فترة تفاقم المرض مديدة قبل ظهور
الأعراض.
المزمن من استنشاق سويات ضعيفة من البيريليوم وهومن نمط الاستجابة التحسسية. يتميز
المرض بتشكل عقد أو تحبب في الرئتين. يمكن أن تكون فترة تفاقم المرض مديدة قبل ظهور
الأعراض.
** من جهة أ خرى، لم تظهر تقارير تشير
إلى الآثار الناجمة عند الإنسان بسبب عبور البيريليوم إلى الجسم عن طريق الغذاء، وذلك
لأن الكمية التي يمتصها الدم قليلة جدا.
إلى الآثار الناجمة عند الإنسان بسبب عبور البيريليوم إلى الجسم عن طريق الغذاء، وذلك
لأن الكمية التي يمتصها الدم قليلة جدا.
** يعد التلامس الجلدي الأثر الأكثر شيوعا
للبيريليوم على الجلد.
للبيريليوم على الجلد.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر






السلام عليكم
لماذا لا يتفاعل البريليوم مع الهيدروجين؟
ضع سؤالك على موقع/ اسألني كيمياء فهو موقع تابع لنا وسوف نجيب عليك بالتفصيل