نصف قطر الذرة Atomic radius
على الرغم من صعوبة تحديد شكل نهائي للذرات أو للأيونات، إلا أنه يمكن اعتبارها على شكل كرات ذات أنصاف أقطار، بحيث أنه في مركب أيوني يكون مجموع نصفي قطر الكاتبون(الحامل للشحنة الموجبة (والأنيون )الحامل للشحنة السالبة) يعطي في النهاية المسافة بين الأيونات في الشبكة البلورية .
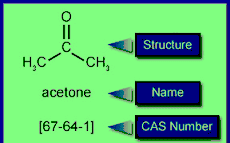
تعريف عام لنصف قطر الذرة:
هو نصف المسافة بين مركزي ذرتين متماثلتين في جزئ ثنائي الذرة .
تعريف عام لطول الرابطة:
هو المسافة بين نواتى ذرتين متحدتين وتقاس طول الرابطة بواسطة الأشعة السينية أو حيود الإلكترونات
تقاس أنصاف الأقطار بوحدات البيكومتر (pm) أو الأنجستروم (A ) عادةً ما تتراوح أنصاف الأقطار بين 30 إلى 200 بيكومتر (0.3 إلى 2 ) أنجستروم.
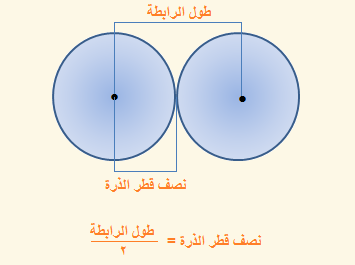
أولاً: نصف القطــر التساهمــى
في حالــة ذرتيـن متماثلتيـن :
نصف القطر التساهمي = نصف المسافة بين نواتى ذرتين متماثلتين ومتحدتين
في حالــة ذرتيـن غيـر متماثلتيــن:
نصف قطر أحدي الذرات = طول الرابطة بين ذرتين غير متماثلتين ـ نصف قطر الذرة الأخرى

نصف قطر ذرة الكربون = طول الرابطة بين الكلور والكربون ـ نصف قطر الذرة الكلور
نصف قطر ذرة الكربون = 1.76 ـ 0.99 = 0.77 أنجستروم
ثانياً: نصف القطر الأيوني
1- نـصف القطــر الأيوني = هو نصف قطر الأنيون أو الكاتيون
2- طــول الرابطـــة هو مجموع نصفى قطري الأيون الموجب والسالب
3- الأيون عبارة عن ذرة فقدت أو اكتسبت إلكترون أو أكثر لتصل إلى حالة الاستقرار الثماني
(أ) نصف القطر للأيون السالب
نصف قطر الايون السالب اكبر من نصف قطر ذرته . وذلك لان الذرة لتتحول إلى ايون سالب يجب عليها أن تكتسب الكترونات فيزيد عدد الشحنات السالبة في المستويات الرئيسية عن عدد الشحنات الموجبة داخل النواة فتصبح قوة الجذب للنواة موزعة على عدد كبير من الالكترونات فيقل جدب النواة.
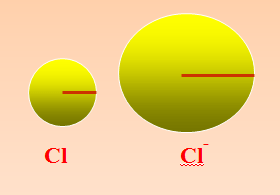
(ب) نصف القطر للأيون الموجب
نصف قطر الايون الموجب اصغر من نصف قطر ذرته لان الذرة لكي تتحول إلى ايون موجب يجب عليها أن تفقد الكترونات لتصل إلى الاستقرار فيقل عدد الالكترونات في المستويات عن عدد البروتونات في النواة فيزداد قوة جذب النواة للالكترونات
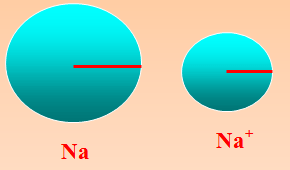
مقارنة بسيطة بين الأيونات الموجبة والسالبة للتوضيح :

تدرج
إنصاف الأقطار في الجدول الدوري
(أ) تدرج
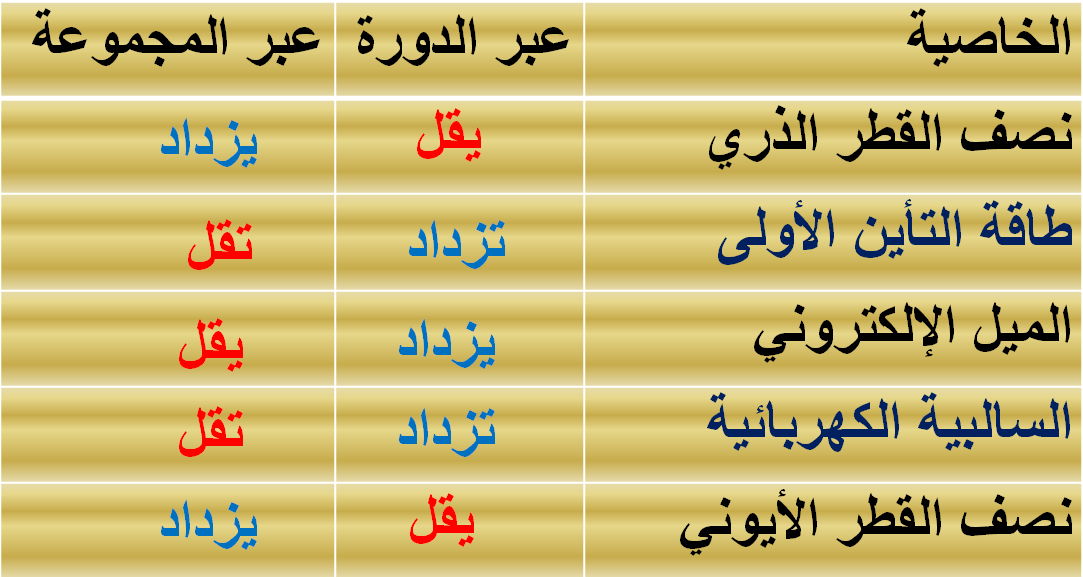
نصف القطر الذرى عبر الدورة الواحدة
القطر الذرى بزيادة العدد الذرى عبر الدورة الواحدة بالانتقال من اليسار إلى
اليمين لأنه بزيادة العدد الذرى تزيد الشحنة الموجبة فتزيد قوة جذبها للإلكترونات في
مستويات الطاقة الخارجية .فتنسحب الإلكترونات نحو النواة. فيقل نصف القطر
(ب) تدرج
نصف القطر الذرى عبر المجموعة الواحدة
يزيد نصف القطر الذرى في المجموعة الواحدة بزيادة العدد الذرى بالانتقال من أعلى إلى أسفل لأنه بالانتقال من أعلى لأسفل عبر المجموعة الواحدة . يزيد العدد الذرى وتزيد الشحنة الموجبة . ولكن في نفس الوقت تزيد عدد مستويات الطاقة المملوءة بالإلكترونات فتحجب قوة جذب النواة للإلكترونات في المستويات الخارجية . فبذلك تقل قوة جذب النواة لهذه الإلكترونات . فيزيد حجم الذرة ويزيد نصف القطر .
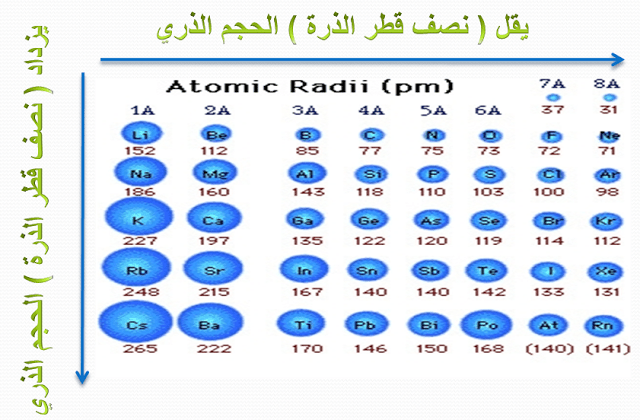
مقارنة توضح تدرج الخواص للعناصر فى الجدول الدورى