الرصاص Lead – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر الرصاص Lead؟
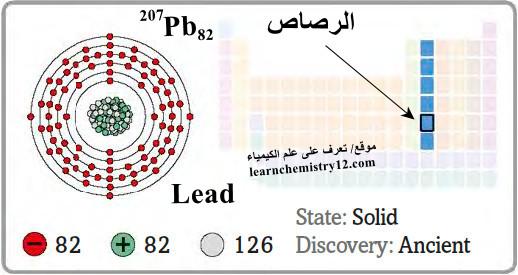
– الرصاص Lead هو عنصر من عناصر الجدول الدوري: العدد الذري = 82 ، العدد الكتلي = 207
– الرمز الكيميائي لعنصر الرصاص يرمز له بالرمز: 207Pb82
– التوزيع الإلكتروني له: Xe]54 6s2 4f14 5d10 6p2]
– الرصـاص فلز ناعم الملمس (لين) مرن لونه رمادي.
– كما أنه قابل للسحب والطرق، موصل رديء للحرارة والكهرباء ومقاوم للتأكل.
– عند تسخينه برفق يتحول إلى ثقوب أو قوالب حلقية.
– كما أنه يعتبر أول الفلزات التي صهرها الإنسان، فالمواسير الرصاصية التي صنعها الرومان ما زالت تستخدم حتى وقتنا الحالي.
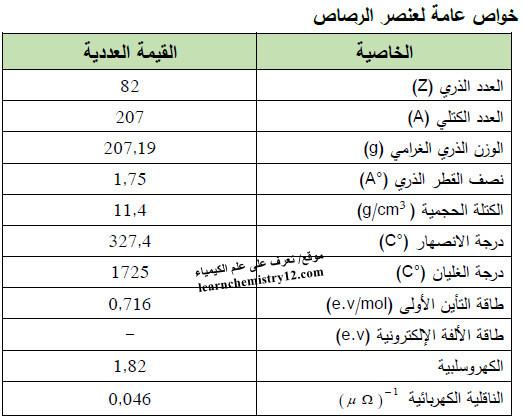
– الجدول التالي يوضح الخواص العامة لعنصر الرصاص كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Lead
– يرمز للرصاص بالرمز Pb ويأتي من الكلمة اللاتينية (Plumbum) ومن هنا جاءت كلمة سباك (Plumber) في العصر الروماني القديم، حيث كانت أنابيب المياه المستخدمة في السباكة تصنع من هذا المعدن الناعم.
– توجد مركبات الرصـاص في معادن الكروكيت Crocoite والأنجليسيت Anglesite والجالينا Galena، وهي المصدر الرئيسي للرصاص النقي.
– لسنوات عديدة، كان يُعتقد أن الرصاص والقصدير شكلان مختلفان لنفس المعدن.
– يوجد الرصـاص في الطبيعة داخل الصخور التربة، النباتات والحيوانات.
– يوجد بشكل نمطي مشتركاً مع عناصر أخرى في صيغة أملاح رصاص ينحل بعضها في الماء.
– تختلف كميات الرصـاص في الطبقات السطحية بشكل كبير، ويمكن أن تكون أعلى بكثير تبعاً للأنشطة البشرية.
تحضير الرصاص Preparation of Lead
– يحضر الرصاص من الغالينا PbS بعد فصل المواد الترابية بعدة طرق نذكر منها:
(1) طريقة الاختزال الذاتي
– تسخن الغالينا في فرن عاكس بدرجة حرارة o500م و o600م، بتمرير تيار من الهواء الساخن عليها، فتتحول جزئياً إلى أكسيد وكبريتات الرصـاص كما بالتفاعل التالي:
2PbS + 3O2 → 2PbO + 2SO2
– وفي المرحلة الثانية ترفع درجة حرارة المزيج قي جو خال من الهواء فيتحرر الرصـاص من الغالينا المتبقية ومن أكسيده وكبريتاته كما بالتفاعلين:
2PbS + 3O2 → 2PbO + 2SO2
PbS + 2PbO → 3Pb + SO2
(2) يحضر الرصاص بتسخين الغالينا مع الحديد في فرن الرصاص
– كما بالتفاعل التالي:
PbS + Fe → FeS + Pb
(3) يستخرج الرصاص من الغالينا حسب طريقة التحليل الكهربائي
– حيث يتحرر الرصاص من الكاثود والكبريت على الأنود.
الخواص الكيميائية لعنصر الرصاص Chemical properties of Lead
(أ) مركبات الرصاص
(1) أكسيد الرصاص PbO
– يحضر بتمرير تيار من الهواء غير مصهور الرصاص وهيدروكسيد الصوديوم.
– كما يمكن تحضيره بالتفكيك الحراري لنترات الرصاص أو كربونات الرصاص.
Pb(NO3)2 → PbO + 2NO2 + 1/2O2
PbCO3 → PbO + CO2
– يعرف لأكسيد الرصـاص حالتين بلوريتين وهما كما يلي:
- أكسيد الرصـاص الأصفر الذي يتبلور حسب نظام المعين Rhombic
- أكسيد الرصـاص الأحمر يتبلور حسب النظام الرباعي Tetragonal
ويتم التحول من حالة إلى أخرى في الدرجة 488Co ، كل منهما ضعيف الانحلال في الماء.
(2) ثاني أكسيد الرصاص PbO2
– يحضر بأكسدة أملاح الرصاص بطريقة التحليل الكهربائي أو بتأثير الكلور أو البروم أو أملاح الكلوريت في وسط قاعدي كما بالتفاعلات الآتية:
+Pb2+ + Cl2 + 6H2O → PbO2 + 2Cl– + 4H3O
+Pb2+ + ClO + 2H2O → PbO2 + 2Cl– + 2H3O
– كما يتفاعل ثاني أكسيد الرصاص PbO2 مع الأكاسيد ذات الصفة الأساسية مشكلاً أملاحه تحتوي على أيونات من نوع –PbO44 و –PbO32 و -2[Pb(OH)] التي توافق الأحماض التالية: H4PbO4 و H2PbO3 و H2[Pb(OH)6]
– يعتبر ثاني أكسيد الرصـاص مؤكسداً قوياً في الأوساط الحمضية كما يتضح من المعادلة:
P bO2 + 4H3O+ + 2e– → Pb2+ + 6H2O
لذلك يؤكسد PbO2 الكثير من المواد.
PbO2 + SO2 → PbSO4
PbO2 + 4HCl → PbCl2 + Cl2 + 2H2O
5PbO2 + 2Mn2+ + 4H3O+ → MnO4– + 5Pb2+ + 6H2O
3PbO2 + 2Cr(OH)3 + 7KOH → 2K2CrO4 +3K[Pb(OH)3]+ 2H2O
– علاوة على ذلك يستعمل مسحوق ثاني أكسيد الرصـاص الممزوج بالكبريت والفوسفور الأحمر في صنع أعواد الثقاب.
(3) رباعي أكسيد ثلاثي الرصاص Pb3O4 أكسيد الرصاص الأحمر
– ينتج بتسخين أكسيد الرصاص PbO في الهواء بالدرجة o500م ، الذي يعد كناتج لاتحاد ثنائي أكسيد ثنائي الرصاص Pb2O2 مع أكسيد الرصاص PbO.
– لا ينحل الأكسيد Pb3O4 في الماء، لكنه ينحل في مصهور نترات البوتاسيوم، يتفكك هذا الأكسيد بتسخينه في الدرجة 400oم، وفي الفراغ يحرر الأكسجين.
– يحدث هذا التفكك نفسه في الهواء بدءاً من الدرجة 550oم التي يكون فيها الضغط الجزئي للأكسجين 0.2 جو.
– كما يتفاعل الأكسيد Pb3O4 مع HNO3 الممدد مكوناً ثنائي أكسيد الرصاص ونترات الرصاص ذي درجة اكسدة (+2)، وتبين خواص الأكاسيد أنه ليس مجرد مزيج من الأكسيدين PbO و PbO2 ، إنما يمكن اعتباره كملح رصاصات الرصـاص Pb2 [PbO4]
(4) هاليدات الرصاص
– تحضر الهاليدات بتأثير PbX2 بتأثير الحمض الموافق HX على أحد مركبات الرصاص (+2) فمثلاً المركبان PbF2 و PbCl2 يحضران كما بالتفاعلان التاليان:
Pb(NO3)2 + 2HF → PbF2 + 2HNO3
PbO + 2HCl → PbCl2 + H2O
(5) مركبات أخرى
– كذلك هناك مركبات أخرى مشهورة لعنصر الرصاص كما يلي:
- ثنائي يوديد الرصـاص PbI2
- ثنائي سيلينيد الرصـاص PbSe
- ثنائي كبريتيد الرصـاص PbS
- رباعي فلوريد الرصـاص PbF4
(ب) التفاعل مع الهواء
– سطح الرصاص المعدني محمي بطبقة من أكسيده، فهو لا يتفاعل مع الهواء.
– أما إذا قمنا بتسخينه في درجات o600م إلى 800o م في وجود الأكسجين فهو يتفاعل معه كما بالتفاعل التالي:
2Pb (s) + O2 (g) → 2PbO (s)
(جـ) التفاعل مع الهالوجينات
في درجة حرارة الغرفة يتفاعل الرصاص مع الكلور والفلور لتشكيل هاليداته السامة كما بالتفاعلات التالية:
Pb (s) +Cl2 (g) → PbCl2 (s)
Pb (s) +F2 (g) → PbF2 (s)
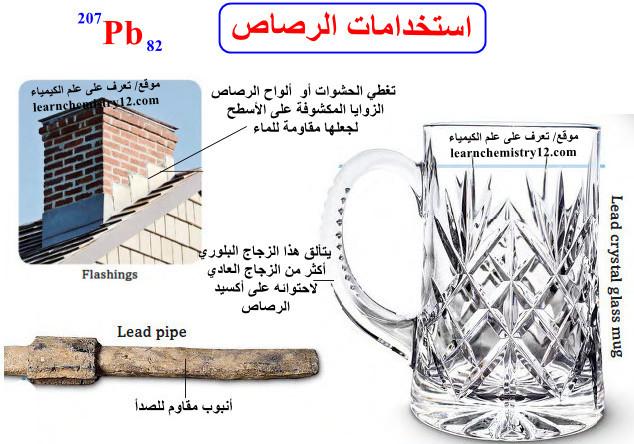
استخدامات الرصاص Uses of Lead
– لقد أستخدم الرصاص في تطبيقات متنوعة منذ آلاف السنين، والاستخدام الرئيسي حالياً يتمثل في إنتاج عدة أنماط من البطاريات ويستعمل كما يلي:
(1) إنتاج الذخائر الحربية ومنتجات معدنية (صفائح ولحام وأنابيب) وتجهيزات طبية (واقيات الإشعاع ومعدات خارجية)، وكذلك الدهانات والخزف المزجج والتجهيزات العلمية.
(2) علاوة على ذلك يستخدم في صناعة الزجاج شديد الدقة في الليزرات وفي التجهيزات البصرية الأخرى.
(3) كما يستعمل الرصـاص في تغليف السطوح المنزلية (على شكل أوراق) وفي مجال الصناعة الكيميائية كمقاوم للتأكل.
(4) نظراً لكون الرصـاص من العناصر الثقيلة غير المشعة فيستعمل لكبح الإشعاعات النووية وامتصاصها.
(5) أما فيما يخص مركباته التي نذكر مها رباعي اثيل الرصـاص ورباعي ميثيل الرصأاص استخدمت لسنوات عديدة في البنزين بغية رفع رقم الأوكتان فيه.
(6) بالإضافة إلى ذلك كان الرصاص يستخدم بشكل أكثر شيوعًا في الماضي كعنصر مهم في الدهانات وصبغات الشعر والمبيدات الحشرية.
(7) كما أنه يستخدم في أوزان الغوص، وبطاريات السيارات، والفلاشات(flashings) المرنة لإغلاق الأسطح لجعلها مقاومة للماء.
تأثير الرصاص على الإنسان
– الرصاص عنصر سام.
– بالنظر إلى الانتشار الواسع للرصـاص في البيئة فهو يدخل الجسم عن طريق استنشاق الهواء، شرب الماء وتناول الطعام، فتتموضع جسيماته في الرئتين وعادة ما تخرج الجسيمات المتموضعة في الجزء العلوي من الرئتين عن طريق السعال، أما المتموضعة عميقاً في الرئتين فتنحل سامحة للرصـاص بالدخول إلى مجرى الدم.
– علاوة على ذلك يشار إلى أنه لدى البالغين يغادر الجسم أثناء الطرح 99% من الرصاص الداخل إلى مجرى الدم، أما ما تبقى فإنه يخزن في العظام والأسنان.
– بالنسبة للأطفال فإن حوالي %70 من الرصاص سيبقى في الجسم ليختزن بشكل رئيسي في العظام.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان. أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson. – consultant Jack Challoner – Great Britain 2017