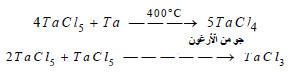التنتالوم Tantalum – الخواص الفيزيائية والكيميائية
محتويات الموضوع
ما هو عنصر التنتالوم Tantalum؟
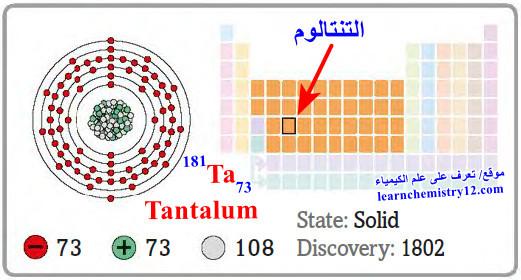
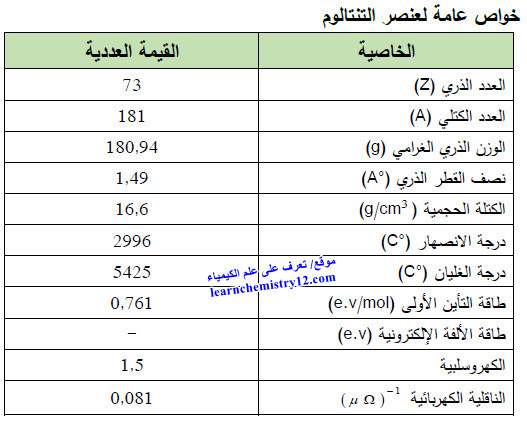
– التنتالوم Tantalum هو عنصر من عناصر الجدول الدوري: العدد الذري = 73، العدد الكتلي = 181
– الرمز الكيميائي لعنصر التنتالوم يرمز له بالرمز: 181Ta73
– التوزيع الإلكتروني له: Xe]54 6s2 4f14 5d3]
– التنتالوم عنصر من العناصر الانتقالية.
– فلز صلب قاس شديد اللمعان.
– بالكاد يتفاعل المعدن النقي مع الهواء، لذلك يبقى لامعًا.
– الشكل التالي يوضح عينة مختبرية من التنتالوم النقي كما يلي:
– المعدن له سطح شمعي داكن.
– الجدول التالي يوضح الخواص العامة لعنصر التنتالوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Tantalum
– اكتشف من قبل الكيميائي السويدي (اكبرغ) سنة 1802م.
– اشتق اسمه من اسم شخصية أسطورية يونانية (Tantalus) وهو ملك العذاب وهو رجل من الأساطير اليونانية عاقبته الآلهة دلالة على العذاب والمعاناة التي لاقاها مكتشف هذا العنصر.
– يتم استخراجه من معدن نادر يسمى التانتاليت Tantalite حيث تحتوي هذه البلورات الصفراء على معدن ستيبوتانتالايت stibiotantalite كما بالشكل التالي:
– يوجد فلزا التنتالوم والنيوبيوم في الطبيعة معاً، والخام (الركاز) المشترك الذي يضمهما هو المعقد نيو بنتال وتركيبه هو Fe [(Nb, Ta) O3]2 ، ويمكن أن تحل ذرة المنجنيز محل ذرة الحديد.
– وقد يوجد كلا العنصرين في خام يحتوي التيتانيوم أو العناصر الأرضية النادرة.
– وتوجد هذه الخامات في المنطقة الاستوائية التي يعثر عليها خاصة في استراليا والبرازيل وزائير.
تحضير التنتالوم Preparation of Tantalum
– تكون عملية استخلاص التنتالوم وفصله عن فلز النيوبيوم صعبة للغاية إلا أن مبدأها يعتمد على تحويل العنصرين لأملاح الصوديوم الذائبة.
– تبدأ العملية بالصهر المؤكسد للفلزات في وسط أساسي ثم إضافة الماء الساخن فنحصل على محلول يحتوي على أيونات نيوبات، تيتانات، تنجستات وموليبيدات في حين يبقى الحديد، المنغنيز والسليكون مع المواد غير الذائبة.
– يفصل المحلول الصودي ويعالج بحمض فنحصل على أحماض أو أكاسيد Mo, Ti, W, Ta, Nb
– يعالج المجموع العام بمحلول فلوريد البوتاسيوم (KF) بوسط من حمض هيدروفلوريك (HF) المركز، فينفصل مركب K2NOF5 قليل الذوبان ويبقى مركب التنتالـوم K2TaF7
– ثم نقوم بفصل فلز التنتالوم من محلول تنتالات البوتاسيوم K2TaF7 بالتحليل الكهربائي.
الخواص الكيميائية لعنصر التنتالوم Chemical properties of Tantalum
(1) أكسيد التنتالـوم الخماسي
– من أهم الأكاسيد لعنصرالتنتاليـوم.
– نحصل عليه من التأثير المباشر للأكسجين في الفلز بالتسخين أو نزع الماء من حمض الفلز الناتج من إماهة الكلوريد الخماسي للفلز كما بالمعادلة التالية:
2TaCl5 + 5H2O ←→ Ta2O5 + 10HCl
– كما يتشكل أيضاً من حرق جميع مركبات الفلز في الأكسجين.
– يعتبر هذا الأكسيد بلا ماء حمض ضعيف (انهيدريد) يتفاعل مع كربونات الصوديوم المنصهرة وتعطي أورثونيوبات الصوديوم:
Ta2O5 + 3Na2CO3 → 3CO2 + 2Na3TaO4
(2) هاليدات التنتالـوم
– يعرف لفلز التنتالوم كلوريد خماسي TaCl5 الذي نحصل عليه من التأثير المباشر لمركبات التنتالـوم أو من معالجة أكاسيده بغاز الكلور Cl2 والكربون، أو رابع كلوريد الكربون CCl4 في وسط متعادل.
2Ta2O5 + 5CCl4 → 4TaCl5 + 5CO2
– أما المركبات الكلورية الأخرى TaCl4 و TaCl3 ، ويمكن تحضيرها كما بالمعادلات التالية:
– جميع المركبات TaCl4 و TaCl3 قابلة للاختزال بالهيدروجين لتعطي فلز التنتالوم الحر.
– كذلك يعطي فلز التنتالـوم فلوريد خماسي TaF5
– كما يمكن تشكيل معقدات مهمة هي: K3[TaF8], K3[TaF6], K2[TaF7]
(3) كربيدات التنتالوم
– يعرف للتنتالـوم نوعان من الكربيدات: TaC,Ta2C
– كذلك تلعب هذه الكربيدات دوراً مهماً في بعض أنواع الفولاذ الخاصة.
(4) نتريدات التنتالوم
– يعرف نتريد واحد للتنتالـوم وهو TaN
(5) كبريتيدات التنتالوم
– يعرف للتنتـالوم الكبريتيد (TaS2) الذي يحضر من تأثير كبريتيد الكربون CS2 على أكسيد التنتالـوم الخماسي Ta2O5
استخدامات التنتالوم Uses of Tantalum
– يستخدم التنتالوم في الصناعة الكيميائية فهو يقاوم تأثير الأحماض ويثبت الكربون داخل الفولاذ.
– نظراً لدرجة انصهاره العالية فإنه يستخدم في الصناعات الإلكترونية.
– هذا المعدن القاسي لا يشكل أي ضرر لجسم الإنسان، لذلك يستخدم في صناعة المفاصل الصناعية وغيرها من عمليات زرع الجسم.
– يستخدم في صناعة الساعات حيث أن هيكل وحزام الساعة الموجودة بالصورة مصنوعان من خليط من التنتالوم والذهب والنحاس.
– يستخدم مسحوق التنتالوم في المكثفات – الأجهزة المستخدمة في الدوائر الإلكترونية لتخزين الكهرباء لذلك تُستخدم مكثفات التنتالوم لتخزين الكثير من الشحنات الكهربائية في دوائر صغيرة، مثل تلك الموجودة داخل الهواتف المحمولة.
– كذلك يعمل هذا المعدن القوي على تقوية الساعات المصنوعة من معادن ثمينة وناعمة.
– علاوة على ذلك يستخدم التنتالوم أيضاً في إنشاء شفرات توربينية turbine blades قوية لا تتآكل.
– العيب الوحيد لهذا العنصر هو ثمنه المرتفع نتيجة لندرته، إن وفرة التنتالوم في قشرة الأرض تقدر بجرامين في الطن.
– المراجع:
- دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.
- The Periodic Table Book – A Visual Encyclopedia of Elements written by Tom Jackson – consultant Jack Challoner – Great Britain 2017