الفضة Silver – الخواص الفيزيائية والكيميائية للفضة
محتويات الموضوع
ما هو عنصر الفضة Silver؟
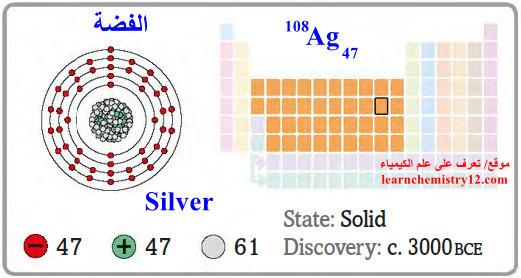
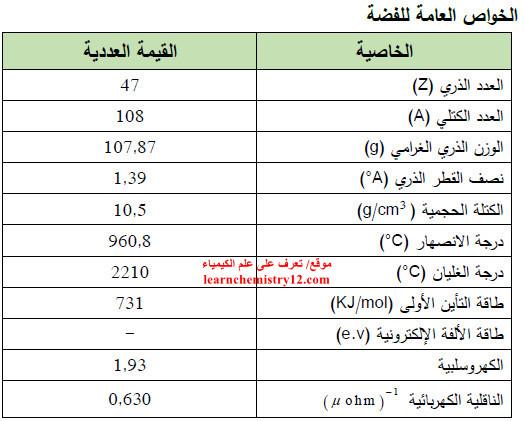
– الفضة Silver هو عنصر من عناصر الجدول الدوري: العدد الذري = 47 ، العدد الكتلي = 108
– الرمز الكيميائي لعنصر الفضة يرمز له بالرمز: 108Ag47
– التوزيع الإلكتروني له: Kr]36 5s1, 4d10]
– الفضة معدن أبيض اللون وعلى درجة عالية من البريق، يمكن صقله وتلميعه.
– هو من أكثر المعادن القابلة للسحب والطرق.
– ومن ناحية توصيلها للحرارة والكهرباء فإنها تتفوق على كل المعادن.
– يعتبر معدنًا ثمينًا لأن شكله النقي له لمعان رمادي لا يتآكل بسرعة، ويبقى ثابتًا إذا تم تنظيفه بانتظام.
– الجدول التالي يوضح الخواص العامة لعنصر الفضة كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Silver
– اكتشفت الفضة من قبل الميلاد، اشتق اسمه من اللاتينية (Argentum) ، ومن اليونانية (Arguros) بمعنى بياض لامع وهذا يعود إلى المنظر الطبيعي لهذا العنصر.
– تعتبر الفضـة من العناصر النادرة في الطبيعة وهي تشكل 6-10 × 4 من وزن القشرة الأرضية
– فهي توجد بنسبة قليلة في المناجم وتكون على شكل كبريت، وتتميز باللمعان والبريق وتدعى الأرجنتيت Argentite وصيغته الكيميائية Ag2S
– كما توجد الفضة الطبيعية في بعض المناجم مع مركبات أخرى لكنها قد تتحول إلى AgCl تحت تأثير الملح والأملاح، وهذا النوع يوجد في تشيلي وجنوب ويلز.
– يتم استخراجها في الغالب من المعادن، مثل البيرارجيرايت Pyrargyrite والأكانثيت Acanthite
طرق تحضير الفضة Preparation of Silver
– تحضر الفضة كما بالطريقة التالية:
4Ag + 8NaCN + O2 + 2H2O → 4Na[Ag(CN)2]2Ag
– ومن ثم تترسب الفضـة من المحلول كما يلي:
2Ag(CN)2– + Zn → [Zn(CN)4]2- + 2Ag
– كما يمكن أن تحضر بطريقة التحليل الكهربائي.
الخواص الكيميائية لعنصر الفضة Chemical properties of Silver
(1) التفاعل مع الأكسجين
– تتفاعل الفضة مع الأكسجين، لتعطي أكسيد الفضـة كما بالمعادلة التالية:
2Ag + 1/2 O2 → Ag2O
(2) التفاعل مع الهالوجينات
– تتفاعل الفضة مع الهالوجينات لتعطي هاليدات كما بالمعادلة العامة التالية:
2Ag + X2 → 2AgX
(3) التفاعل مع الكبريت
– تتأثر الفضة بالكبريت فتتشكل عليها طبقة سوداء من Ag2Sعند تعرضها الجو كما بالمعادلة التالية:
2Ag + S → Ag2S
(4) التفاعل مع الأحماض
– تتفاعل الفضة مع الأحماض مثل حمض الكبريتيك H2SO4 وحمض الهيدروكلوريك HCl كما بالمعالات التالية:
2Ag + 2H2SO4 → Ag2SO4 + SO2 + 2H2O
2Ag + 2HCl + 1/2O2 → 2AgCl + H2O
استخدامات الفضة Uses of Silver
(1) تستعمل هالوجينات الفضـة الحساسة بالضوء لتحضير طبقات حساسة ضوئيا على ورق التصوير.
(2) تستخدم في إنتاج الحلي والأساور وأكسسورات الأحجار الكريمة وطلاء المرايا.
(3) بعض الناس يستخدمون رقائق الفضة المسطحة لتزيين الطعام.
(4) كانت الملاعق والشوك الفضية هي القطع الوحيدة من أدوات المائدة التي لم تخلق نكهة معدنية سيئة في الفم في الأيام التي سبقت اختراع الفولاذ المقاوم للصدأ.
(5) كما تشكل الفضـة مركبات حساسة للضوء بالكلور (المستخدم في النظارات الشمسية) والبروم (المستخدم في لوحات التصوير القديمة) حيث يتحول الزجاج المشبع بكلوريد الفضـة إلى اللون البني عند تعرضه لأشعة الشمس.
(6) نترات الفضة (مركب من الفضـة والنيتروجين والأكسجين) مطهر معتدل يستخدم في بعض أنواع الصابون المضاد للبكتيريا.
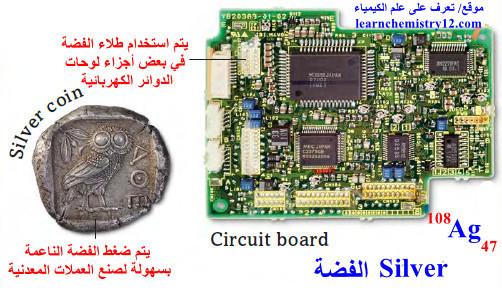
(7) علاوة على ذلك توصل الفضة الكهرباء أفضل من النحاس، وتستخدم في بعض لوحات الدوائر.
(8) نظرًا لقيمة هذا العنصر ويمكن تشكيله بسهولة، فقد تم استخدام الفضة النقية تاريخياً لصنع العملات المعدنية.
(9) كما تستخدم في البطاريات ذات النوعية الممتازة.
(10) في حالة عدم وجود غيوم، يمكن للعلماء تكوين قطرات صغيرة من الماء تتشبث بمسحوق يوديد الفضـة، مكونة غيوم مطر صناعية.
تأثير الفضة على جسم الإنسان
– التعرض للأبخرة المتصاعدة من الفضة تسبب دوار صعوبة في التنفس، صداع.
– التركيزات العالية من الفضة من الممكن أن تسبب للإنسان إحساس بالنعاس، عدم التركيز، فقد الوعي، الغيبوبة أو الموت.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.