الباريوم Barium – الخواص الفيزيائية والكيميائية للباريوم
محتويات الموضوع
ما هو عنصر الباريوم Barium؟
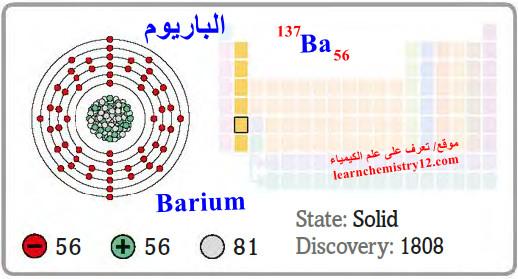
– الباريوم Barium هو عنصر من عناصر الجدول الدوري: العدد الذري = 56 ، العدد الكتلي = 137
– الرمز الكيميائي لعنصر الباريوم يرمز له بالرمز: 137Ba56
– التوزيع الإلكتروني له: Xe]54 6s2]
– الباريوم فلز أبيض فضي طري، نشط جداً من الناحية الكيميائية.
– يشتعل بمجرد تسخينه تسخيناً خفيفاً أو تعرضه لصدمة بسيطة من الأكسجين.
– فالسطح اللامع للباريوم المحضر لتوه يتغطى بسرعة بطبقة من أكسيده لدى تعرضه للهواء والماء لهذا يحفظ كغيره من الفلزات ذات الطبع الحاد، تحت طبقة الكيروسين.
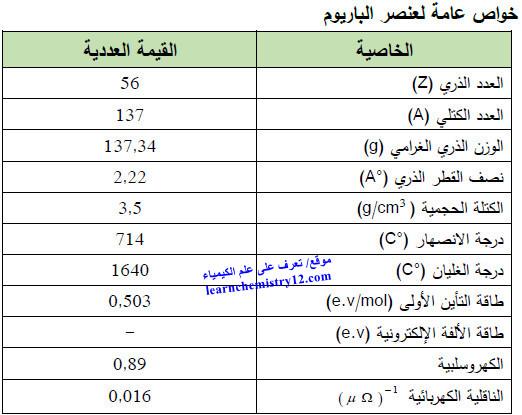
– الجدول التالي يوضح الخواص العامة لعنصر الباريوم كما يلي:
اكتشافه ووجوده في الطبيعة Discovery of Barium
– تم اكتشاف الشكل النقي لهذا العنصر لأول مرة في عام 1808م من قبل الكيميائي الإنجليزي همفري ديفي، الذي استخرجه من أكسيد الباريـوم.
– حصل عليها ديفي عن طريق تسخين معدن Witherite
– سمى الباريوم بهذا الاسم من اليونانية (barys) بمعنى ثقيل وهذا راجع لكثافته العالية مقارنة بعناصر مجموعته.
– يدخل في تركيب القشرة الأرضية بنسبة %0.04
– كما يعثر عليه في الغالب بحالة كبريتات تسمى أحياناً الاسبات الثقيل.
– وهو من حيث الوفرة في الطبيعة العنصر السابع عشر.
– من المعادن التي تحتوي على الباريوم هي كما يلي:
Witherite الذي يستخدم في صناعة طلاء السيراميك Ceramic glazes
Desert rose تتشكل عندما تختلط رمال الصحراء مع الباريت أو الجبس.
Benitoite تحتوى البلورات الزجاجية الزرقاء على الباريـوم والتيتانيوم وهو معدن نادر.
تحضير الباريوم Preparation of Barium
– يحضر الباريـوم من اختزال أكسيده بواسطة الألمنيوم.
مركبات الباريوم Barium Compound
(1) أكسيد الباريوم BaO
– مركب كيميائي يكون على شكل بلورات بيضاء اللون مسامية لكنها كثيفة.
– يحضر أكسيد الباريـوم بالتفكك الحراري لكربونات الباريـوم.
– تجرى عملية التحضير صناعياً وفي درجات حرارة عالية 1450مo.
– ولتخفيض درجة الحرارة اللازمة للتفكك تتم إضافة مسحوق هباب الفحم إلى جملة التفاعل، مما يساعد في عملية تفكك الكربونات وذلك بسبب سحب الغاز الناتج من التفاعل وهو غاز ثنائي أكسيد الكربون، فينزاح ثابت توازن التفاعل نحو الاتجاه المباشر، بإضافة الكربون يتفاعل غاز ثاني أكسيد الكربون معه مشكلاً غاز أول أكسيد الكربون، وبالتالي يكفي الوصول إلى 1100م لحدوث التفكك والحصول على الناتج كما بالمعادلات الآتية:
C + CO2 → 2CO
BaCO3 → BaO
– من خواص أكسيد الباريوم أنه يتفاعل مع الماء بشكل عنيف مشكلاً هيدروكسيد الباريـوم.
– بالإضافة إلى ذلك فأنه ينحل في كل من الميثانول الإيثانول بشكل جيد.
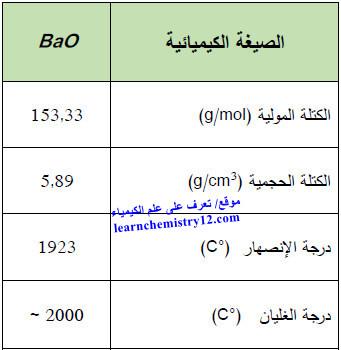
الجدول التالي يبين الخواص الفيزيائية لأكسيد الباريـوم في الشروط النظامية كما يلي:
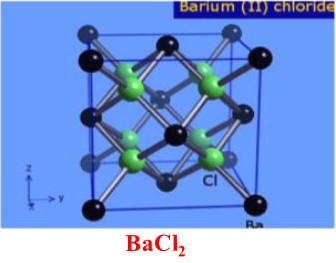
(2) كلوريد الباريوم BaCl2
– يعد كلوريد الباريوم من أكثر الأملاح أهمية، وهو سام.
– يحضر من تأثير حمض كلور الماء على محلول من مركب كبريتيد الباريـوم، وذلك حسب القاعدة الكيميائية المعروفة أن الحمض القوي يطرد الحمض الضعيف من أملاحه كما بالتفاعل التالي:
BaS + 2HCl → BaCl2 + H2S
– وفي حالة وجود شاردة الكبريتات في المحلول يتشكل راسب أبيض من كبريتات الباريـوم صعب الانحلال كما يلي:
SO42-(aq) + Ba2+(aq) → BaSO4(s)
– ينحل مركب كلوريد الباريـوم بشكل جيد في الماء، وبالتسخين فوق 25مo يستغني عن جزيئة واحدة من الماء ليصبح أحادي هيدرات، وبمتابعة التسخين إلى فوق 100مo نحصل على الشكل اللامائي لمركب كلوريد الباريـوم.
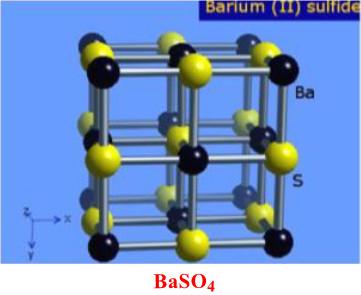
(3) كبريتات الباريوم BaSO4
– مركب كيميائي على شكل مسحوق بلوري أبيض.
– يوجد بشكل واسع في الطبيعة على شكل فلز الباريت الذي يمثل المصدر الرئيسي للباريوم ومركباته.
– يحضر من تفاعل كلوريد الباريوم مع كبريتات الصوديوم، حيث يترسب مركب كبريتات الباريوم في المحلول على شكل راسب أبيض ناعم كما يلي:
BaCl2 + Na2SO4 → 2NaCl + BaSO4
– تتميز كبريتات الباريـوم بصعوبة الانحلال في الماء بشكل كبير وثباته الكيميائي، ونظراً لمميزاته هذه فأنه يستخدم كخضاب أبيض مع مركب كبريتيد الزنك، حيث يطلق على اسم مزيجها اسم (ليتوبون) الذي يحصل عليه من مزج محاليل من كبريتات الباريوم مع كبريتات الزنك كما بالتفاعل التالي:
ZnS + BaSO4 → BaS + ZnSO4
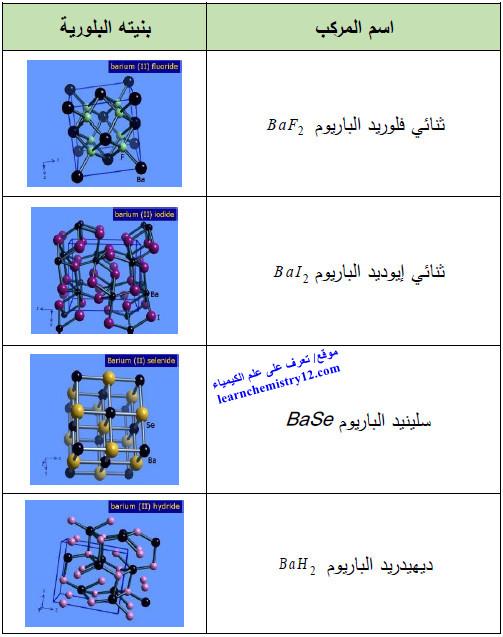
(4) مركبات أخرى
الجدول التالي يوضح أهم مركبات الباريوم الأخرى المشهور كما يلي:
الخواص الكيميائية لعنصر الباريوم Chemical properties of Barium
(1) التفاعل مع الهواء
– يتفاعل معدن الباريوم مع الأكسجين والنيتروجين الموجودان في الهواء، كما بالتفاعلات التالية:
2Ba(s) + O2(g) → 2BaO(s)
Ba(s) + O2(g) → BaO2(s)
3Ba(s) + N2(g) → Ba3N2(s)
(2) التفاعل مع الماء
– يتفاعل الباريوم بسهولة مع الماء ليعطي هيدروكسيده كما بالتفاعل التالي:
Ba(s) + 2H2O → Ba(OH)2(aq) + H2(g)
(3) التفاعل مع الهالوجينات
– يتفاعل الباريوم مع الهالوجينات لتشكيل هيدريداته كما التفاعلات التالية:
Ba(s) + Cl2(g) → BaCl2(s)
Ba(s) + Br2(g) → BaBr2(s)
– كما يتفاعل مع اليود أيضاً بنفس الطريقة:
Ba(s) + I2(g) → BaI2(s)
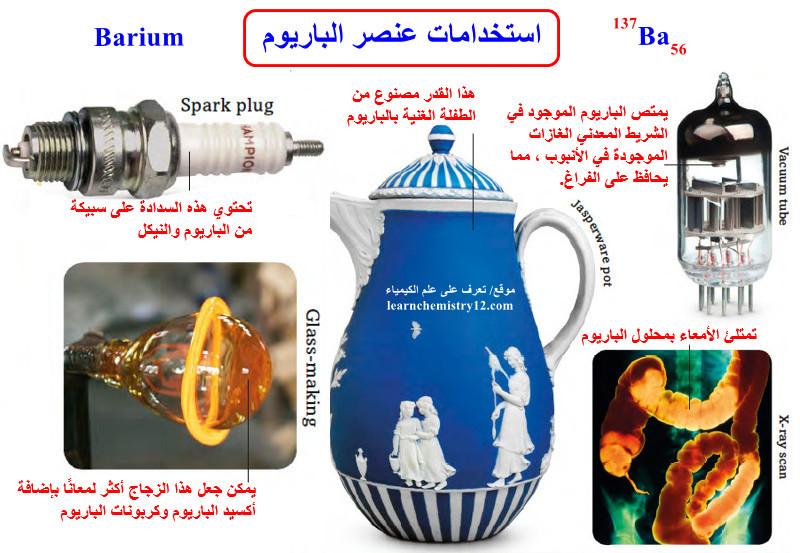
استخدامات الباريوم Uses of Barium
(1) يستخدم الباريوم بكميات قليلة في تعدين الرصاص والنحاس بغية تنقيتهما من الكبريت والغازات.
(2) تستخدم سبائك الباريوم مع النيكل في صنع الكترودات شمع الاشتعال في المحركات وبعض القطع في مصابيح الأجهزة الالكترونية لجعلها تنتج شرارات أكثر قوة.
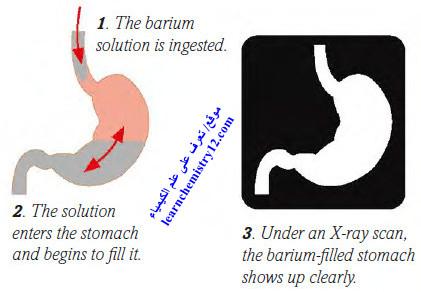
(3) تكمن فائدة الباريوم في عدم انحلال أملاحه التي تستعمل في المجال الطبي، إذ أنه إذا أراد أحد الأطباء الحصول على صورة إشعاعية لأحد أعضاء الجسم مثلاً كالمعدة فأنه يعطي للمريض كمية من كبريتات الباريـوم فيظهر جهازه الهضمي في الصورة بلون قاتم مع جميع تفاصيله فوق خلفية مضيئة حيث يجعل الباريوم أعضاء الجهاز الهضمي اللينة أكثر كثافة، مما يسمح برؤيتها بوضوح باستخدام جهاز الأشعة السينية.
(4) يستعمل الباريوم كذلك في صناعة الأصبغة والأصناف الغالية من الورق، خاصة الأوراق النقدية وأوراق الأسهم والسندات، حيث تلعب كبريتات الباريـوم دور مادة حشو وتثقيل تجعل الورق أكثر تراصاً وبياضاً.
(5) يستخدم كلوريد الباريوم لتحضير مركب كبريتات الباريـوم، أما في الكيمياء التحليلية فيستخدم للكشف عن شاردة الكبريت، حيث يحضر محلول 0.5 مول منه (12,2جم من كلوريد الباريـوم في 100 مل من الماء) وتضاف قطرات قليلة منه إلى المحلول المراد الكشف عن الكبريتات فيه والذي يكون محمضا.
(6) علاوة على ذلك يضاف الى الزجاج لزيادة لمعانه.
(7) تضاف مركبات الباريوم إلى بعض أنواع الطين (الطفلة Clay) المستخدمة في صنع الأواني والمزهريات.
(8) في آبار النفط، تضاف مركبات الباريـوم إلى سوائل الحفر لزيادة كثافتها.
– المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.