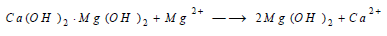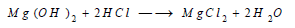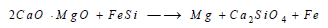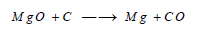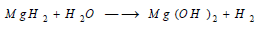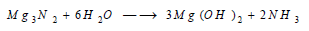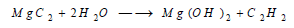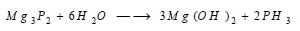أولاً/ ما هو عنصر الماغنسيوم؟ What is Magnesium element
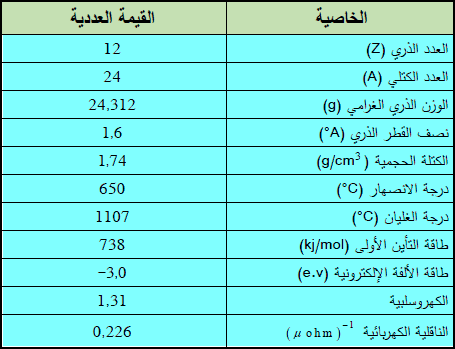
– هو عنصر من عناصر الجدول الدوري يرمز له بالرمز (Mg) ، العدد الذري= 12 العدد الكتلي = 24
– عبارة عن معدن، ينتمي إلى مجموعة المعادن القلوية الترابية في الجدول الدوري للعناصر.
– هذا المعدن ذو لون أبيض فضي يزول بالتعرض للهواء نتيجة تأكسده.
– يتمتع (Mg) بناقلية جيدة للحرارة والكهرباء.
– الجدول التالي يوضح بعض الخواص العامة لعنصر (Mg) :
ثانياً/ اكتشاف الماغنسيوم ووجوده في الطبيعة Discovery of Magnesium
– عُزل معدن (Mg) لأول مرة عام 1808م على يد ديفي (Davi).
– اشتق من (Mg) أسمه من اليونانية (Magnésia) منطقة من آسيا الصغرى(وفي مصادر أ خرى في اسكتلندا) حيث وجد معدنه الخام (أكسيد الماغنسيوم).
– ويقال أيضاً بأن أصل التسمية من اللاتينية والألمانية natrium مشتق من natron كلمة تشير إلى وجود هذا الملح على شواطئ بحيرة Natron .
– لا يوجد (Mg) بشكل حر في الطبيعة وذلك لشدة فعاليته، ولكن خاماته واسعة الانتشار في اليابسة ومياه البحر.
– لا يوجد هذا العنصر بشكل حر في الطبيعة لأنّه سريع التأكسد في الهواء، ويتفاعل بشكل عنيف مع الماء، أي يجب حفظه في وسط غير مؤكسد.
– أهم خامات الماغنسيوم:
الماغنيزيت MgCO3
الدولوميت MgCO3.CaCO3
أملاح ابسوم (Epsom) MgSO4.7H2O
الكيسيريت MgSO4.H2O
الكارناليت KCl.MgCl2.6H2O
الأولفين (Olivine) Mg2SiO4
الإينشتايت MgSiO3
– يشكل (Mg) أملاحاً منحلة في ماء البحر 0.13%
ثالثاً/ تحضير عنصر الماغنسيوم Preparation of Magnesium
– يحضر (Mg) بعدة طرق وأهمها:
(أ) يحضر (Mg) عملياً بمعالجة هيدروكسيد الكالسيوم بمياه البحر الغني بشوارد Mg2+ وتعتمد هذ الطريقة على معالجة ماء البحر بهيدروكسيد الكالسيوم فيرسب (Mg) الأقل انحلالية ثم يرشح ويعالج بحمض كلور الماء لتحويلها إلى MgCl2 ثم يحلل مصهور هذا الملح كهربائيا، أما مراحل هذه الطريقة فهي:
(1) تكليس أحجار الدولوميت:
(2) تشكيل هيدروكسيد الماغنسيوم والكالسيوم وذلك بمعالجة الناتج بالماء:
(3) المعالجة بمياه البحر:
(4) تشكيل كلوريد الماغنسيوم:
(5) التحليل الكهربائي لمصهور كلوريد الماغنسيوم:
وذلك في حوض حديدي (مهبط) ومصعد من الغرافيت ويحلل كهربائياً في الدرجة 700 Co يضاف عادة بعض الأملاح الأخرى لخفض درجة انصهار هذا الملح مثل KCl أو NaCl حيث تنخفض درجة انصهار المزيج الملحي إلى حوالي 300 Co :
(ب) يمكن تحضير (Mg) مباشرة بعد عملية تكليس أحجار الدولوميت وذلك بالطريقة الحرارية التي تعتمد على إرجاع أكسيد الكالسيوم والماغنسيوم (CaO + MgO) بواسطة فحم الكوك عند الدرجة 2000 Co أو باستعمال مزيج من الحديد أو السيليكون:
(جـ) يمكن تحضير (Mg) بإختزال الأكسيد بالكربون في قوس كهربائية )طريقة هانكجيرك):
رابعاً/ الخواص الكيميائية لعنصر الماغنسيوم Chemical properties of Magnesium
(1) التفاعل مع الأكسجين Reaction between Magnesium and Oxgyen
يتفاعل (Mg) بالتسخين في جو من الأكسجين ويتشكل أكسيد الماغنسيوم:
(2)التفاعل مع الماء Reaction between Magnesium and water
(Mg) المسخن لا يتفاعل إلا مع تيار من بخار الماء، ويتشكل أكسيد الماغنسيوم:
(3)التفاعل مع الهيدروجين HydrogenReaction between Magnesium and
يمكن (Mg) أن يشكل MgH2 وذلك بحرارة عالية جدا وضغط مناسب وهو هيدريد غير ثابت. وينحل هذا الهيدريد في ماء مشكلاً هيدروكسيد الماغنسيوم وينطلق غاز الهيدروجين:
(4)التفاعل مع أشباه المعادن non-metalsReaction between Magnesium and
(أ) تفاعل (Mg) مع النيتروجين (الآزوت):
يتفاعل (Mg) مع الآزوت بالتسخين إلى درجات مناسبة ويشكل النتريد Mg3N2 الذي يتحمله بسرعة في الماء ويتشكل هيدروكسيد الماغنسيوم وينطلق غاز النشادر:
(ب) تفاعل (Mg) مع الكربون:
يتفاعل (Mg) بالتسخين مع الكربون ويتشكل كبريد أو أستيليد المغنزيوم الذي صيغته MgC2 ويتصف هذا المركب بأنه يتحلل بالماء مشكلاً هيدروكسيد الماغنسيوم وينطلق غاز الأستيلين:
(جـ) تفاعل (Mg) مع الفسفور:
يتفاعل (Mg) مع الفوسفور بالحرارة ويتشكل فوسفيد الماغنسيوم Mg3P2 الذي يتحمله بسرعة بالماء ويتشكل هيدروكسيد المغنزيوم وينطلق غاز الفوسفين:
(د) تفاعل (Mg) مع جميع الهالوجينات:
يتشكل هاليد الماغنسيوم MgX2 وكذلك يتفاعل مع الكبريت ويتشكل كبريتيد الماغنسيوم MgS الذي يتحلمه بالماء يطلق عاز الهيدروجين.
(5) التفاعل مع الأحماض AcidesReaction between Magnesium and
– يتفاعل (Mg) مع الحموض الممددة مثل HCl و H2SO4 وينطلق غاز الهيدروجين:
– أما حمض الآزوت فالماغنسيوم يتفاعل مع الممدد جدا، ويطلق غاز الهيدروجين:
– كما يتفاعل مع حمض الكبريت الكثيف والساخن وفق التفاعل التالي:
خامساً/ استخدامات عنصر الماغنسيوم Uses of Magnesium
(1) يستعمل (Mg) في صناعة الخلائط المعدنية، وفي تحضير المواد النارية بسبب الضوء الشديد المتولد عن احتراقه.
(2) يدخل مع بعض المعادن في تكوين سبائك تمتاز بخواص ميكانيكية جيدة والتي تستخدم في صناعة الطائرات وأجزاء البواخر.
(3) يستخدم (Mg) في مصابيح التصوير (فلاش) ، وكذلك في صناعة الأسنان.
(4) يدخل في تكوين شبكات الأقنية تحت الأرض ، كما يستخدم أكسيد الماغنسيوم كمادة عاكسة للحرارة في باطن الأرض.
المراجع: دراسة كيميائية تحليلية مفصلة لعناصر الجدول الدوري / الأستاذ الدكتور حسن بوزيّان أستاذ بقسم الكيمياء بالمدرسة العليا للأساتذة / الجزء الأول / أبريل 2017 / الجزائر.