الكيمياءالكيمياء العامةعناصر الجدول الدورى
وصف الجدول الدوري للعناصر Description of Periodic table

نشأة الجدول الدوري
** على الرغم من قيام عدد من العلماء بترتيب بعض أو جميع
العناصر الكيميائية المعروفة في وقتهم في أشكال معينة ووفقاً للأسس محددة وبفترة
زمنية سبقت زمن إعلان العالم الروسي مندليف إلا أن مندليف يعتبر واضع أول جدول
تترتب فيه العناصر الكيميائية المعروفة آنذاك وفقاً لأوزانها الذرية والتدرج في
الخواص (دورية الخواص) وذلك سنة 1869م.
العناصر الكيميائية المعروفة في وقتهم في أشكال معينة ووفقاً للأسس محددة وبفترة
زمنية سبقت زمن إعلان العالم الروسي مندليف إلا أن مندليف يعتبر واضع أول جدول
تترتب فيه العناصر الكيميائية المعروفة آنذاك وفقاً لأوزانها الذرية والتدرج في
الخواص (دورية الخواص) وذلك سنة 1869م.
** أعطى مندليف الأفضلية إلى التدرج فى الخواص على الوزن
الذري للعنصر في حالة عدم اتفاق خواص العنصر ذات الوزن الذري المناسب مع خواص
العنصر الذي يسبقه أو يتقدم علية. بالإضافة إلى ذلك ومن الأمور التي يشهد بها إلى
مندليف هو توقعه وجود عناصر ذات أوزان ذرية وخواص محددين لم تكن معروفة في زمانه
ولهذا السبب فقد ترك مجالات محددة شاغرة في جدوله المقترح حيث ثبت صحة ودقة
توقعاته فيما بعد اكتشاف هذه العناصر.
الذري للعنصر في حالة عدم اتفاق خواص العنصر ذات الوزن الذري المناسب مع خواص
العنصر الذي يسبقه أو يتقدم علية. بالإضافة إلى ذلك ومن الأمور التي يشهد بها إلى
مندليف هو توقعه وجود عناصر ذات أوزان ذرية وخواص محددين لم تكن معروفة في زمانه
ولهذا السبب فقد ترك مجالات محددة شاغرة في جدوله المقترح حيث ثبت صحة ودقة
توقعاته فيما بعد اكتشاف هذه العناصر.
** في أوائل القرن التاسع عشر وبعد عمله مع أطياف أشعة أكس (X-rays
spectra) أعلن هنري موزلي القانون الدوري والذي ينص على “الصفات
الكيميائية والفيزيائية للعناصر ومركباتها تعتبر دوال دورية لأعداها الذرية”
وبهذا يكون قد أسس لاعتماد العدد الذري بدلاً من الوزن الذري لترتيب العناصر فى
الجدول الدوري. حيث يلاحظ حصول تشابهات دورية متكررة بين كل عنصر والعنصر الذي يقع
تحته (عناصر نفس المجموعة)
spectra) أعلن هنري موزلي القانون الدوري والذي ينص على “الصفات
الكيميائية والفيزيائية للعناصر ومركباتها تعتبر دوال دورية لأعداها الذرية”
وبهذا يكون قد أسس لاعتماد العدد الذري بدلاً من الوزن الذري لترتيب العناصر فى
الجدول الدوري. حيث يلاحظ حصول تشابهات دورية متكررة بين كل عنصر والعنصر الذي يقع
تحته (عناصر نفس المجموعة)
تكوين الجدول الدوري
يتكون الجدول الدوري من سبع صفوف أفقية (Horizontal
Rows)
تسمي بالدورات (Periods) وثمانية عشر صفاً
عمودياً تسمي بالمجموعات (Groups).
Rows)
تسمي بالدورات (Periods) وثمانية عشر صفاً
عمودياً تسمي بالمجموعات (Groups).
الدورات
يتكون الجدول
الدوري من سبع صفوف أفقية (Horizontal Rows) تسمي بالدورات (Periods) ، تترتب فيه عناصر الجدول الدوري حسب الزيادة في العدد الذري من اليسار
إلى اليمين ، تبدأ كل دورة بذرة عنصر تمتلك إلكتروناً واحداً فقط في غلافها
التكافئي وتنتهي بذرة عنصر تمتلك غلاف تكافئياً تاماً، توصف الدورات الثلاث الأولي
بالدورات القصيرة حيث تتشكل من 2,8,8 عناصر على التوالي، الدورة
الرابعة والخامسة تتشكل كل منها من 18 عنصراً أما الدورة السادسة فتتشكل من 32
عنصراً بينما الدورة السابعة تتشكل من 22 عنصراً ، أغلب عناصر الدورة السابعة
عناصر مشعة غير طبيعية.
الدوري من سبع صفوف أفقية (Horizontal Rows) تسمي بالدورات (Periods) ، تترتب فيه عناصر الجدول الدوري حسب الزيادة في العدد الذري من اليسار
إلى اليمين ، تبدأ كل دورة بذرة عنصر تمتلك إلكتروناً واحداً فقط في غلافها
التكافئي وتنتهي بذرة عنصر تمتلك غلاف تكافئياً تاماً، توصف الدورات الثلاث الأولي
بالدورات القصيرة حيث تتشكل من 2,8,8 عناصر على التوالي، الدورة
الرابعة والخامسة تتشكل كل منها من 18 عنصراً أما الدورة السادسة فتتشكل من 32
عنصراً بينما الدورة السابعة تتشكل من 22 عنصراً ، أغلب عناصر الدورة السابعة
عناصر مشعة غير طبيعية.
المجموعات
يتكون الجدول
الدوري من ثمانية عشر صفاً عمودياً تسمي بالمجموعات (Groups). ثمانية مجموعات رأسية
وعشرة فرعية عناصر تتشابه في خواصها
الكيميائية توصل الاتحاد العالمي للكيمياء النظرية والتطبيقية IUPAC عام 1984م إلى اعتماد الأرقام العربية (1,2,3,4,…..) بدلاً
من الأرقام الرومانية (I,II,III,IV,…..) في ترقيم المجموعات.
الدوري من ثمانية عشر صفاً عمودياً تسمي بالمجموعات (Groups). ثمانية مجموعات رأسية
وعشرة فرعية عناصر تتشابه في خواصها
الكيميائية توصل الاتحاد العالمي للكيمياء النظرية والتطبيقية IUPAC عام 1984م إلى اعتماد الأرقام العربية (1,2,3,4,…..) بدلاً
من الأرقام الرومانية (I,II,III,IV,…..) في ترقيم المجموعات.
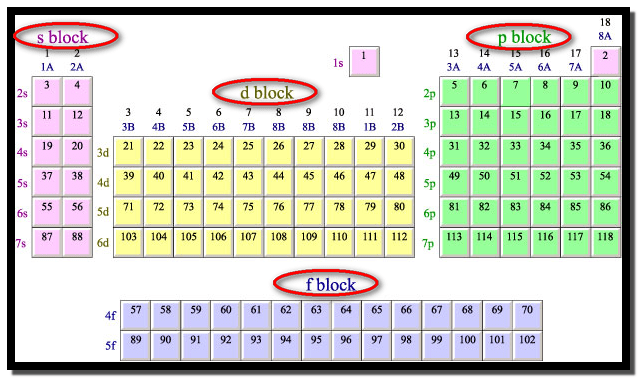
تقسيم الجدول الدوري
يمكن تقسيم الجدول الدوري إلى أربعة مجمعات رئيسية وذلك حسب
نوع الغلاف الثانوي الأخير الذي يظهر في الترتيب الإلكتروني لذرات العناصر التي
تشكل هذه المجمعات:
نوع الغلاف الثانوي الأخير الذي يظهر في الترتيب الإلكتروني لذرات العناصر التي
تشكل هذه المجمعات:
(1) عناصر المجمع ( الفئة) S S-Block element
ينتهي الترتيب الإلكتروني لذرات عناصر هذا المجمع بالغلاف
الثانوي S ، وعناصر
هذه المجموعة مبينة في الجانب الأيسر من الجدول الدوري ، يتكون هذا المجمع من مجموعتين من العناصر
التي تسمي بالمعادن الخفيفة (Light Metals).
الثانوي S ، وعناصر
هذه المجموعة مبينة في الجانب الأيسر من الجدول الدوري ، يتكون هذا المجمع من مجموعتين من العناصر
التي تسمي بالمعادن الخفيفة (Light Metals).
أ) مجموعة المعادن القلوية (Alkali metals) – وتشمل المجموعة IA
ب) مجموعة معادن الأتربة القلوية (alkali earth metals) – وتشمل المجموعة IIA
(2) عناصر المجمع ( الفئة) P P-Block
element
element
ينتهي الترتيب الإلكتروني لذرات عناصر هذا المجمع بالغلاف
الثانوي P ، عناصر
هذه المجموعة مبينة في الجانب الأيمن من الجدول الدوري ويضم هذا المجمع ست مجموعات ( من المجموعة
13- إلى المجموعة 18) حيث تسمى المجموعة الثامنة عشرة (أو أحياناً تسمى المجموعة
الصفرية) بمجموعة الغازات المثالية ، أما المجموعة السابعة عشر فتسمى بمجموعة
الهالوجينات.
الثانوي P ، عناصر
هذه المجموعة مبينة في الجانب الأيمن من الجدول الدوري ويضم هذا المجمع ست مجموعات ( من المجموعة
13- إلى المجموعة 18) حيث تسمى المجموعة الثامنة عشرة (أو أحياناً تسمى المجموعة
الصفرية) بمجموعة الغازات المثالية ، أما المجموعة السابعة عشر فتسمى بمجموعة
الهالوجينات.
(3) عناصر المجمع ( الفئة) d d-Block element
ينتهي الترتيب
الإلكتروني لذرات عناصر هذا المجمع بالغلاف الثانوي d تسمى العناصر التي ينتهي الترتيب
الإلكتروني لذراتها أو أحد أيوناتها بالغلاف ndx (حيث X= 1إلى 9) بالعناصر الانتقالية الأساسية.
وتشتمل هذا المجمع على ثلاث سلاسل Series
من العناصر وهي:
الإلكتروني لذرات عناصر هذا المجمع بالغلاف الثانوي d تسمى العناصر التي ينتهي الترتيب
الإلكتروني لذراتها أو أحد أيوناتها بالغلاف ndx (حيث X= 1إلى 9) بالعناصر الانتقالية الأساسية.
وتشتمل هذا المجمع على ثلاث سلاسل Series
من العناصر وهي:
(أ) السلسلة الانتقالية الأولي 3d
ينتهي الترتيب الإلكتروني لعناصر هذه المجموعة بـ 3dx ( حيث
يشير x إلى عدد الإلكترونات ، x= 1 إلى
9 ولا تساوي صفر أو 10).
يشير x إلى عدد الإلكترونات ، x= 1 إلى
9 ولا تساوي صفر أو 10).
(ب) السلسلة الانتقالية الثانية 4d
ينتهي الترتيب الإلكتروني لعناصر هذه المجموعة بـ 4dx ( حيث
يشير x إلى عدد الإلكترونات ، x= 1 إلى
9 ولا تساوي صفر أو 10).
يشير x إلى عدد الإلكترونات ، x= 1 إلى
9 ولا تساوي صفر أو 10).
(جـ) السلسلة الانتقالية الثالثة 5d
ينتهي الترتيب الإلكتروني لعناصر هذه المجموعة بـ 5dx ( حيث
يشير x إلى عدد الإلكترونات ، x= 1 إلى
9 ولا تساوي صفر أو 10). وعلى الرغم من أن هذه السلسلة تبدأ بلنثينوم (La57) إلا
أنه لا يعتبر أحد أعضاء هذه السلسلة
يشير x إلى عدد الإلكترونات ، x= 1 إلى
9 ولا تساوي صفر أو 10). وعلى الرغم من أن هذه السلسلة تبدأ بلنثينوم (La57) إلا
أنه لا يعتبر أحد أعضاء هذه السلسلة
(4) عناصر المجمع ( الفئة) f f-Block element
ينتهي الترتيب الإلكتروني لذرات هذا المجمع بالغلاف الثانوي f حيث تسمى عناصر هذا المجمع بالعناصر الانتقالية
الداخلية (Inner-transition element) ، يتكون هذا المجمع من
سلسلتين من العناصر وهما:
الداخلية (Inner-transition element) ، يتكون هذا المجمع من
سلسلتين من العناصر وهما:
أ) سلسلة اللانثنايد (Lanthanide series) :
ينتهي الترتيب الإلكتروني لذرات هذه السلسلة بالغلاف 4f
ينتهي الترتيب الإلكتروني لذرات هذه السلسلة بالغلاف 4f
ب) سلسلة الإكتنايد (Actinide series) :
ينتهي الترتيب الإلكتروني لذرات هذه السلسة بالغلاف الثانوي 5f
ينتهي الترتيب الإلكتروني لذرات هذه السلسة بالغلاف الثانوي 5f
تسمى عناصر المجمع d ، وعناصر المجمع f بالمعادن الثقيلة (Heavy Metals).
تحديد موقع العنصر فى الجدول الدوري
من الممكن تحديد موقع (الدورة والمجموعة) ذرة أي عنصر في
الجدول الدوري من خلال كتابة الترتيب الإلكتروني الصحيح للذرة حيث يمثل:
الجدول الدوري من خلال كتابة الترتيب الإلكتروني الصحيح للذرة حيث يمثل:
** رقم الغلاف الرئيسي الأخير (غلاف التكافؤ) = رقم الدورة
** مجموع الإلكترونات الموجودة فى الغلاف الرئيسي الأخير =
رقم المجموعة
رقم المجموعة
مثال: حدد الدورة والمجموعة الذي ينتمي إليهما عنصر السيلكون (Si14)
للإجابة على هذا السؤال يوصى بإتباع الخطوات التالية:
(أ) كتابة الترتيب الإلكتروني لذرة السليكون Si14
1s2 2s2 2p6
3s2 3p2
3s2 3p2
(ب) تحديد الغلاف الرئيسي الأخير وذلك بوضع خط مستقيم تحته
3s2
3p2
3p2
** رقم الغلاف الرئيسي = 3 = رقم الدورة
** مجموعة الإلكترونات فى الغلاف الرئيسي الأخير = 2+2 = 4 = رقم
المجموعة
نستنتج من ذلك أن : السيلكون Si14 ينتمي إلى الدورة
الثالثة المجموعة الرابعة
تحميل محاضرة عن الجدول الدوري
يمكنك تحميل محاضرة كاملة عن الجدول الدورى مكونة من 14 صفحة صادرة عن جامعة الأندلس الخاصة للعلوم الطبية
طريقة التحميل
** كل ما عليك فعله لتحميل الكتاب هو الضغط على كلمة (تحميل المحاضرة) وسيتم توجيهك مباشرة لصفحة تحميل المحاضرة.
** إذا لم يتم توجيهك لصفحة تحميل المحاضرة مباشرة أو أن الرابط لا يعمل، فقط قم بإبلاغنا في التعليقات عن ذلك وسنقوم خلال 24 ساعة بحل المشكلة.
** إذا أردت كتاباَ معيناً في أى فرع من فروع علم الكيمياء، فقم بالدخول إلى قسم اتصل بنا وأرسل لنا أيميل فيه صورة الكتاب أو اسمه ، وأن شاء الله تعالى نعمل على توفيره لك مجاناً أو مدفوعاً حسب رغبة المالك الأصلي للحفاظ على حقوق الطبع والنشر إذا أمكن ذلك.
** كما يمكنك تحميل العديد من الكتب الكيميائية والمحاضرات والدورات المتعلقة بالكيمياء وذلك بالذهاب إلى الصفحة الرئيسية قسم “كتب كيميائية ” أو عبر الرابط التالي: كتب كيميائية
المراجع
** إذا لم يتم توجيهك لصفحة تحميل المحاضرة مباشرة أو أن الرابط لا يعمل، فقط قم بإبلاغنا في التعليقات عن ذلك وسنقوم خلال 24 ساعة بحل المشكلة.
** إذا أردت كتاباَ معيناً في أى فرع من فروع علم الكيمياء، فقم بالدخول إلى قسم اتصل بنا وأرسل لنا أيميل فيه صورة الكتاب أو اسمه ، وأن شاء الله تعالى نعمل على توفيره لك مجاناً أو مدفوعاً حسب رغبة المالك الأصلي للحفاظ على حقوق الطبع والنشر إذا أمكن ذلك.
** كما يمكنك تحميل العديد من الكتب الكيميائية والمحاضرات والدورات المتعلقة بالكيمياء وذلك بالذهاب إلى الصفحة الرئيسية قسم “كتب كيميائية ” أو عبر الرابط التالي: كتب كيميائية
المراجع
– إنتاج كيميائي – الكيمياء العامة – 180 كيم، الإدارة العامة لتصميم وتطوير المناهج- المملكة العربية السعودية.






