أسئلة وإجاباتالكيمياءالكيمياء العامة
مسائل محلولة على قانون شارل للغازات Solved problems on Charle’s Law

نص قانون شارل
أن علاقة حجم الغاز ودرجة الحرارة التى تم دراستها من قبل العالم الفرنسي تشارلز 1787م، وطورها العالم جاي لوساك في عام 1802م تبين العلاقة بين الحجم ودرجة الحرارة للغازات. وتنص هذه العلاقة على أنه:
“عند ضغط ثابت، یزداد (أو یقل) حجم كمیة معینة من أي غاز بمقدار ثابت (1/273.15) من حجمھا عند درجة الصفر المئوي كلما ازدادت (أو قلت) درجة حرارة الغاز بمقدار درجة مئویة واحدة”.
الصیغة الریاضیة لقانون شارل
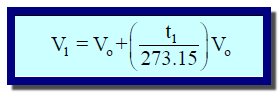
** المقدار V0(t1/273.15) : یعبر عن مقدار التغیر في الحجم (زیادة بزیادة درجة الحرارة، أو نقصاً بنقصان درجة الحرارة)
** المقدار (1/273.15) : يعرف بمعامل التمدد الحراري الحجمى. حيث وجد أن العديد من الغازات مثل الأكسجين O2 والنيتروجين N2 والهيليوم He والنشادر NH3 وثاني أكسيد الكربون CO2 وثاني أكسيد الكبريت SO2 والآرجون Ar لها نفس معامل التمدد الحجمى الحراري أي (1/273.15)
للتبسيط فى حساباتنا سوف نستخدم الرقم (273) بدلاً من (1/273.15) وإهمال الرقم العشري الصغير (0.15)
للتبسيط فى حساباتنا سوف نستخدم الرقم (273) بدلاً من (1/273.15) وإهمال الرقم العشري الصغير (0.15)

قانون شارل الجديد
** بعد اكتشاف تدريج درجة الحرارة المطلقة يمكن استنباط علاقة بين الحجم (V) ودرجة الحرارة (T) على نمط قانون بويل حيث وجد أن :
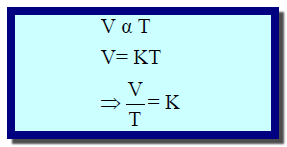
** تعرف النتیجة السابقة بقانون جاي لوساك الذي طورھا، كما تسمي أحیاناً بقانون تشارلز لأنه ھو الذي ابتدأھا، وتنص ھذه النتیجة على أنه :
“عند ثبوت الضغط یتناسب حجم كمیة معینة من غاز ما تناسباً طردیاً مع درجة الحرارة المطلقة”.
The volume of a fixed amount of gas at constant pressure is directly proportional to the absolute temperature
** وفي كثیر من الأحیان نتعامل مع حجم كتلة معلومة من غاز عند درجتین مختلفتین من الحرارة لذلك یمكننا استخدام العلاقة العامة للحجم ودرجة الحرارة للغاز المثالي عند ثبوت الضغط في صورتھا الآتیة:
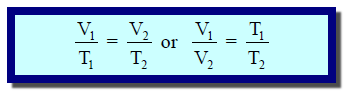
وھذه العلاقة صحیحة فقط عندما یعبر عن درجة الحرارة بالمقیاس المطلق.
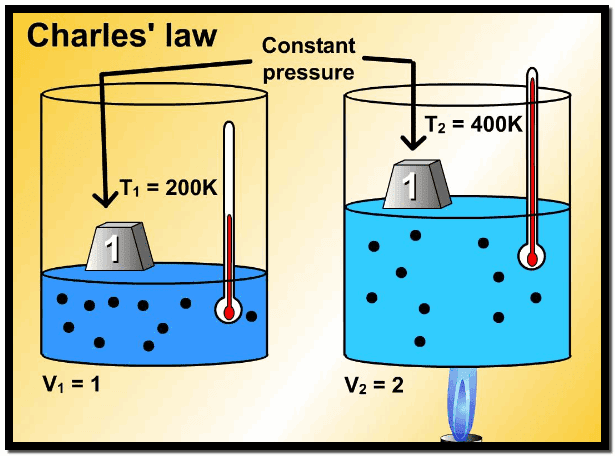
مسائل محلولة على قانون شارل
مثال (1): أثبت من خلال قانون شارل أنه عند درجة حرارة الصفر المطلق (-273 Co) فإن حجم الغاز يؤول إلى الصفر.
الحل :
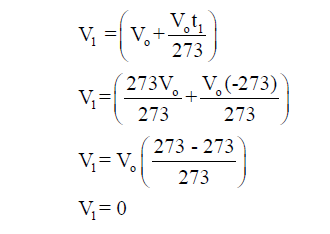
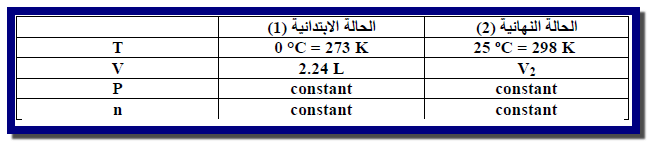
مثال (2): يبلغ حجم كمية معينة من غاز ما (22.4
L) عند ضغط يساوي (1 atm) ودرجة حرارة تساوي (0 Co) ما
حجم نفس الكمية عند نفس الضغط ، وعند درجة حرارة الغرفة (25 Co)؟
L) عند ضغط يساوي (1 atm) ودرجة حرارة تساوي (0 Co) ما
حجم نفس الكمية عند نفس الضغط ، وعند درجة حرارة الغرفة (25 Co)؟
لحل هذه المسألة نضع جدولاً يتضمن الحالة الابتدائية
والنهائية:
والنهائية:
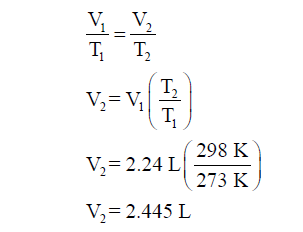
مثال (3): ما الحجم النهائي (V2) لعينة من غاز حجمها الابتدائي (V1) يساوي
650 cm3 عند 25 Co إذا
سخنت إلى 400 Co مع ثبات الضغط ؟
الحل:
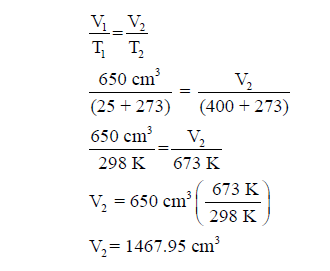
مثال (4): بالون حجمه 2L عند درجة حرارة 25 Coفإذا أخذ للخارج في أيام البرد القارص حيث كانت درجة الحرارة -30 Co . فكم
سيصبح حجم البالون إذا كان الغط داخل البالون ثابت؟
سيصبح حجم البالون إذا كان الغط داخل البالون ثابت؟
الحل:
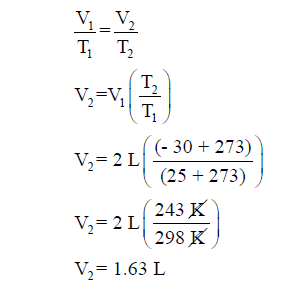
المراجع
– أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية
– أسس الكيمياء العامة والفيزيائية- الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية