الطاقة الحرة Free Energy والإتزان الكيميائي

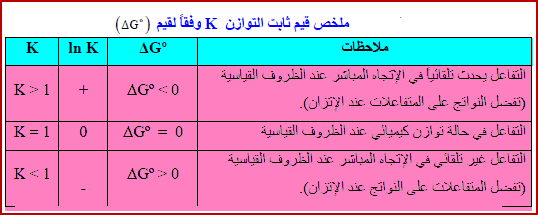
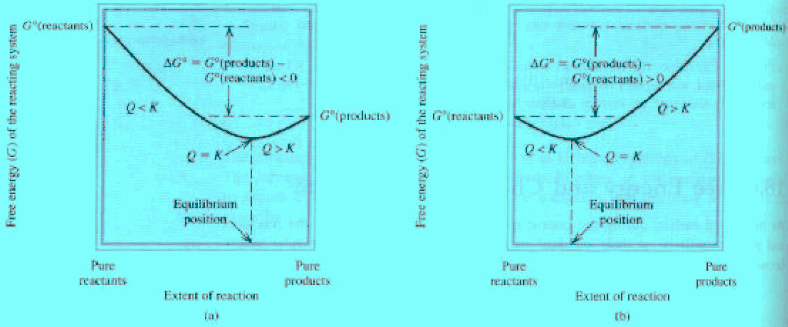
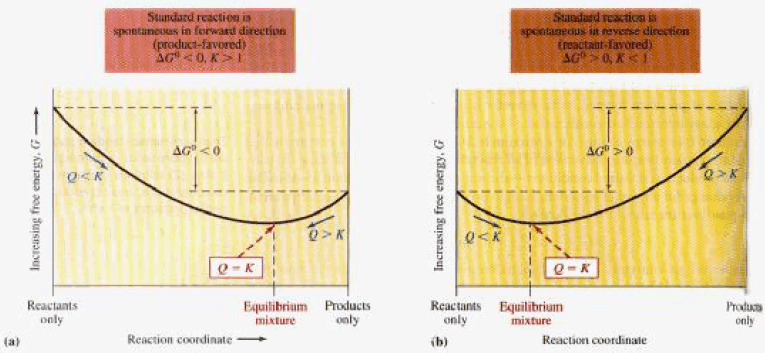
العلاقة بين رائز التفاعل (Q) والطاقة الحرة (ΔG)
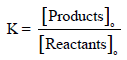
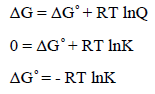
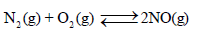
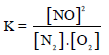
إن قيمة (KC) المنخفضة جداً تعني أن تركیز NO عند الإتزان سوف یكون قلیلاً جداً. قد یكون من الأسھل في ھذه
الحالة استخراج قیمة (KC) من التغیر في الطاقة الحرة القیاسیة (ΔGo) للتفاعل.
بالمقابل نجد أن ثابت الإتزان لتكون یودید الھیدروجین (HI) من الھیدروجین الجزیئي والیود الجزیئي یقترب من الوحدة عند درجة حرارة الغرفة.
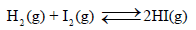
قيم ثابت التوازن K وفقاً لقيم ΔGo
(1) إذا كانت قيمة ΔGo < 0
فإن: (ΔGo = -) ويكون In K = +)) وبالتالي فإن (K>1) للتفاعل وبذلك یكون التفاعل تلقائیاً عند الظروف القیاسیة في الإتجاه المباشر (من الیسار الى الیمین) أي نحو تكوین المواد الناتجة.
(2) إذا كانت قيمة ΔGo > 0
فإن: (ΔGo = +) ويكون In K = -)) وبالتالي فإن (K<1) للتفاعل وبذلك یكون التفاعل غير التلقائي عند الظروف القیاسیة في الإتجاه المباشر أي أن التفاعل ليس لدية القابلية لتكوين النواتج.
(3) إذا كانت قيمة ΔGo = 0
فإن: InK = 0)) وبالتالي فإن (K=1) للتفاعل وبذلك یكون التفاعل في حالة توازن كیمیائي عند الظروف القیاسیة.
– الجدول التالي يوضح ملخص قيم ثابت التوازن K وفقاً لقيم ΔGo
أمثلة محلولة
مثال(1):
إذا علمت أن التغیر في الطاقة الحرة القیاسیة ΔGo للتفاعل التالي ΔGo= – 103.72 k J تساوي عند درجة حرارة 25 Co :
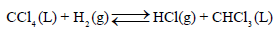
(أ) احسب ثابت التوازن عند 25 Co علماً بأن .(R = 8.314 J/K. mol)
(ب) احسب ΔG للتفاعل عندما یكون ضغط (PH2 = 10 atm, PHCl = 0.1 atm) ثم حدد اتجاه التفاعل عند هذه الظروف.
الحل:
(أ) یمكن حساب ثابت الإتزان من العلاقة:
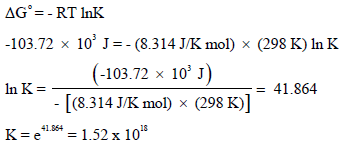
(ب) حساب قيمة ΔG للتفاعل عندما یكون ضغط (PH2 = 10 atm, PHCl = 0.1 atm) نتبع العلاقة:
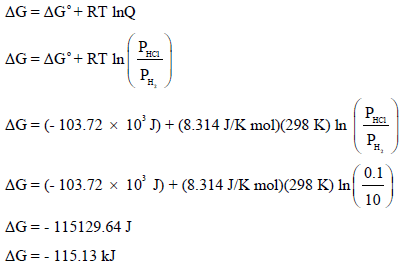
وبما أن قیمة التغیر في الطاقة الحرة بالسالب ((ΔG = – فإن التفاعل یكون تلقائیاً و یسیر بالتالي من الیسار (المتفاعلات) الى الیمین (النواتج).
مثال (2):
إذا كانت قیمة ثابت الإتزان (K) للتفاعل التالي:
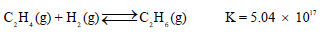
عند درجة حرارة 25 Co . احسب ΔGo لهدرجة الإيثلين C2H4 عند هذه الدرجة من الحرارة.
الحل:
يمكن حساب ΔGo عند الإتزان للتفاعل السابق من العلاقة:

مثال(3):
احسب ΔGo لكلوريد الفضة (AgCl) عند درجة حرارة (25 Co) إذا علمت أن ثابت الذوبانية Ksp = 1.6 × 10-10 حيث (R = 8.314 J/K.mol)
الحل:
حاصل الذوبانیة Ksp هنا هو ثابت الإتزان KC :
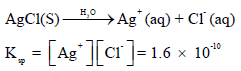
وبالتالي فإن:
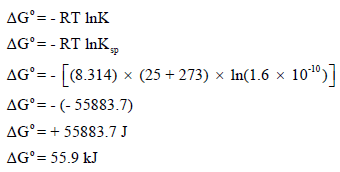
وقيمة ΔGo الموجبة العالية تتفق مع حقيقة أن AgCl يذوب بقلة وبالتالى فإن الإتزان يكون مفضلاً جهة المتفاعلات.
مثال (4):
مستخدماً النتائج لقیم حرارة التكوین القیاسیة احسب ثابت الإتزان للتفاعل التالي:
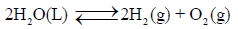
عند درجة حرارة 25 Co علماً بأن: (R = 8.314 J/K. mol) ، (ΔGo (H2O) = -237.2 kJ/mol)
الحل:
أولاً: حساب التغیر في الطاقة الحرة القیاسیة للتفاعل:
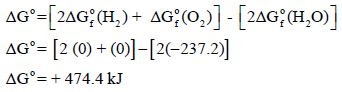
وبما أن قیمة التغیر في الطاقة الحرة بالموجب فإن ھذا التفاعل غیر تلقائي.
ثانياً: حساب قیم ثابت الإتزان K نتبع العلاقة:
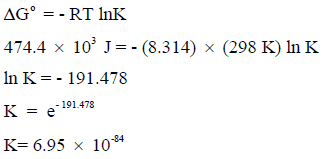
قيمة K المنخفضة تدل على أن تحول الماء الى غازي الھیدروجین والأكسجین منخفض جداً الى قیمة یمكن إھمالھا والقول بأن ھذا التفاعل لا یحدث.
المراجع: أسس الكيمياء العامة والفيزيائية – الجزء الأول.عمر بن عبد الله الهزازي ، قسم الكيمياء- كلية العلوم – جامعة أم القرى – المملكة العربية السعودية






