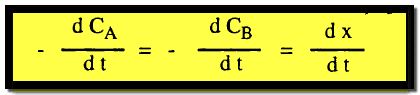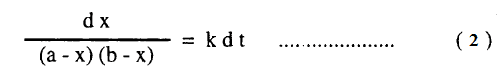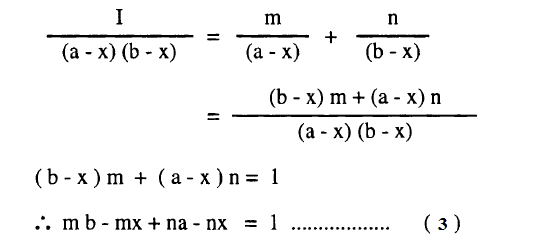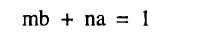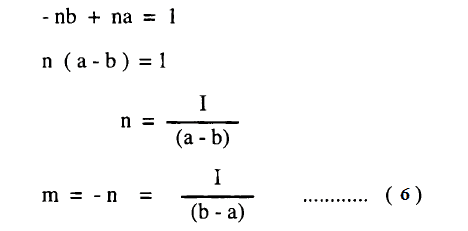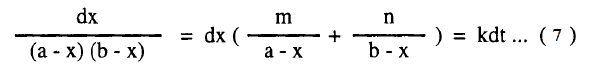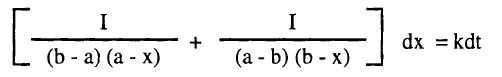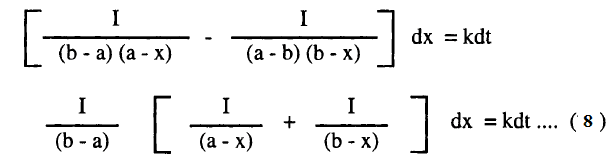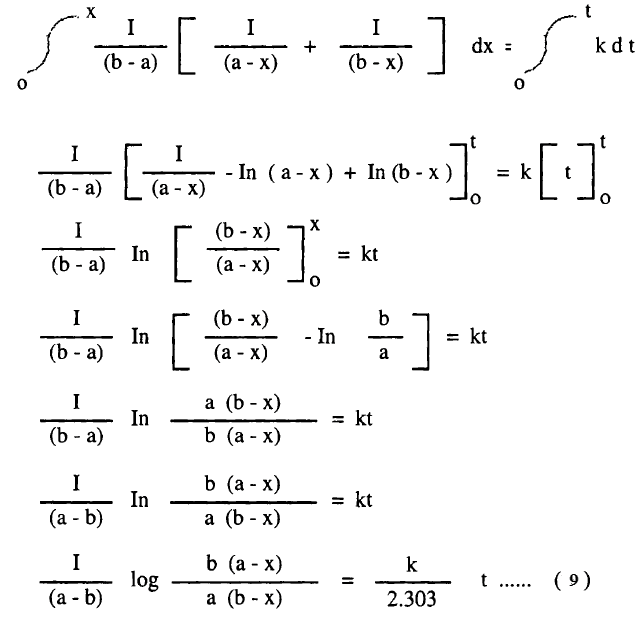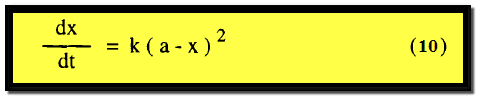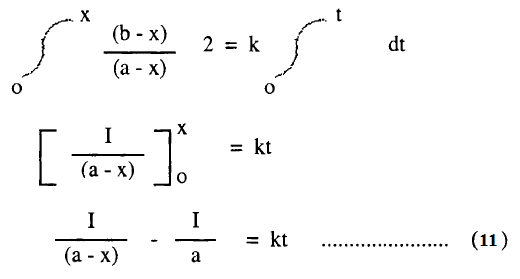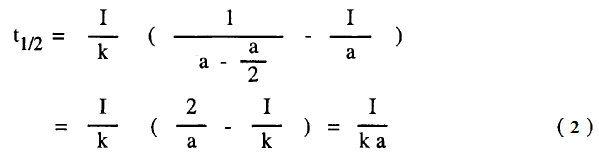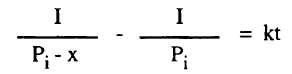تفاعلات الرتبة الثانية Second Order Reactions

تفاعلات الرتبة الثانية هي التفاعلات التي تعتمد فيها سرعة التفاعل على تركيزين ويوجد نوعان من هذه التفاعلات:
(1) النوع الأول:
ويمثل بالمعادلة العامة:
A + B → Products
حيث تتناسب سرعة التفاعل مع تركيز كل من المواد المتفاعلة مرفوعاً إلى أس واحد
Rate α CACB
(2) النوع الثاني:
ويمثل بالمعادلة العامة:
2A → Products
حيث تتناسب سرعة التفاعل مع مربع تركيز المادة A أي أن:
Rate α CA2
وفيما يلي سنعبر عن سرعة التفاعل في كل من الحالتين بمعلومية تركيز المواد المتفاعلة في زمن معين
استنتاج المعادلة الحركية لتفاعلات الرتبة الثانيـة
النوع الأول من تفاعلات الرتبة الثانيـة
A + B → Products
وتمثل سرعة التفاعل كما يلي :
حيث dx/dt هي سرعة التفاعل بالنسبة لاختفاء أي من A أو B وعلى هذا فأنه بالنسبة لتفاعل من الرتبة الثانية تكون السرعة :
حيث a ، b في التركيزات الأولية للمواد A ، B على التوالي، x هي تركيز المادة A أو B المتفاعلة في زمن t ، k هي ثابت السرعة للتفاعل ، ويمكن كتابة المعادلة (1) في الصورة الآتية:
ولتسهيل عملية التكامل لهذه المعادلة نعبر عن الحاصل 1/(a-x)(b-x) بمجموع الحدين الآتيين:
ويوضح معامل x = صفر
ويوضح معامل x = صفر في المعادلة (3)
ومن المعادلات (4) ، (5) ينتج أن:
وبالتعويض في المعادلة (2)
وبالتعويض من (6) في (7) كما يلي:
وبإجراء التكامل للمعادلة (8) بين الحدود x = 0 عند t = 0 ، x = x عند t = t
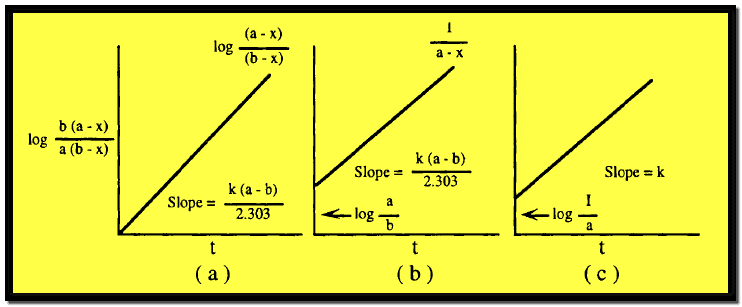
وهذه هي المعادلة الحركية لتفاعل من الرتبة الثانية يتضمن مادتين مختلفتين ويتضح منها أن رسم العلاقة بين log b (a-x) / a (b-x) والزمن t يعطي خطاً مستقيماً ماراً بنقطة الأصل ، وله ميل يساوي k (a-b) / 2.303 كما هو مبين بالشكل التالي:
النوع الثاني من تفاعلات الرتبة الثانية
عندما تكون المادتان A ، B موجودتين بنفس التركيز الأول أي b = a أو عندما تكون A ، B هما نفس المادة كما في المعادلة العامة.
2A → Products
ويكون التعبير عن السرعة كما يلي:
وبفصل المتغيرات وإجراء التكامل بين الحدود نحصل على :
برسم العلاقة بين 1/ (a-x) مع الزمن له ميل يساويK وتقاطع يساوي 1/a كما هو مبين في الشكل السابق رقم (C)
وحدات ثابت السرعة لتفاعلات الرتبة الثانيـة K
يتضح من المعادلة رقم (11) أن وحدات K هي :
وبالتعبير عن التركيز بالجزئي جرام في اللتر والزمن بالثانية فإن :
K = 1 mole-1 sec-1
أي أن القيمة العددية لثابت السرعة في تفاعل الرتبة الثانية تختلف عن الرتبة الأولى في أنها تعتمد على التركيز.
فترة نصف العمر Half Life period
– تعرف فترة نصف العمر لأي تفاعل بأنها
(الزمن اللازم لكي ينخفض تركيز المادة المتفاعلة إلى نصف قيمته الأولية) أو (الزمن اللازم لإتمام نصف التفاعل)
– لا يمكن تعيين فترة عمر النصف عندما تختلف تركيزات المواد A ، B لأن كل منهما لها قيمة مختلفة من فترة نصف العمر ولكن يمكن تعيينها إذا كانت التركيزات متساوية أو إذا كانت المادتان المتفاعلتان من نفس النوع وبالتعويض عن (x) بالقيمة a/2 يمكن الحصول على فترة نصف العمر كما يلي:
أي أنه في تفاعلات الرتبة الثانية تتناسب فترة نصف العمر تناسباً عكسياً مع التركيز الأول (الابتدائي).
أمثلة لتفاعلات الرتبة الثانية
(أ) تفاعلات غازية من الرتبـة الثانيـة
ومن أمثلتها التحلل الحراري التحلل الحراري لكل من يوديد الهيدروجين ، ثاني أكسيد النيتروجين ، الأوزون ، أول أكسيد الكلور ، كلوريد النيتروزيل ، الفورمالدهيد والأسيتالدهيد وكذلك اتحاد الهيدروجين واليود. فمثلاً في حالة تحلل الأسيتالدهيد
حيث أنه في هذا التفاعل يزداد الضغط عند ثبوت الحجم يمكن دراسة سرعة التفاعل بقياس الزيادة في الضغط بمانومتر متصل بالوعاء الذي يحتوي التفاعل ويمكن حساب ثابت السرعة كالآتي:
نفرض أن: Pi هي الضغط الأولى للأسيتالدهيد ، x هي النقص في ضغطه بعد الزمن t أي أن ضغط الأسيتالدهيد عند زمن t يساوي (Pi – x) وعندما ينقص ضغط الأسيتالدهيد بالقيمة x فإن ضغط كل من الميثان وأول أكسيد الكربون يزداد بالقيمة x ويعبر عن الضغط الكلي للنظام كما يلي:
P = PCH3CHO + PCH4 + PCO
= (Pi – x) + x + x
= Pi + x
⸫ x = P – Pi
Pi –x = a –x⸫
Pi = a
وبالتعويض في المعادلة (11) نحصل على :
ومنها نحصل على قيمة K
(ب) تفاعلات الرتبـة الثانيـة في المحاليل
ومن أمثلتها التميؤ القاعدي للإسترات وتفاعل هاليدات الألكيل مع الأمينات واتحاد أيونات الأمونيوم والسيانات لتكوين اليوريا وكذلك أسترة الأحماض العضوية فمثلاً في حالة تميؤ خلات الإيثيل بواسطة أيونات الهيدروكسيد
CH3CH2COOC2H5 + OH– → CH3CH2COO– + C2H5OH
ويحضر مخلوط التفاعل بخلط محاليل مائية معلومة التركيز من خلات الإيثيل وهيدروكسيدالباريوم لكي تعطي تركيزات أزلية تساوي a من الأستر ، b من القاعدة ، وتقاس سرعة التفاعل بأخذ عينات من المخلوط وتخفيفها بواسطة الماء البارد لإيقاف التفاعل ثم معايرتها بحمض قياسي.
ويتضح من المعادلة الكيميائية أن النقص في تركيز الهيدروكسيد يمثل الكمية المتفاعلة x وبذلك يمكن تعيين كل من (a – x) ، (b – x) وبالتعويض في المعادلة (39) يمكن حساب قيمة K
المراجع : – الكيمياء الحركية والكهربية.محمد مجدي عبد الله واصل ، الطبعة لأولى (1425هـ – 2004م) / دار النشر للجامعات – القاهرة – جمهورية مصر العربية